| Terug naar overzicht | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieper in het water gedoken (5) |
tww oktober 2023 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Door: Jan Wurpel
Door: Jan Wurpel
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dit is het vijfde hoofdstuk in deze serie over water en water om mee te brouwen. Het is waarschijnlijk wel het moeilijkste hoofdstuk om te lezen en te begrijpen. Het beschrijft het mechanisme van alkaliteit en de uiteindelijke Rest Alkaliteit waarmee gebrouwen gaat worden. Deze laatste is nu echt de crux voor een effectieve maisch en een goed smakend bier. Om het goed te kunnen begrijpen is kennis van scheikunde op een zeker niveau wel noodzakelijk. Voor degene die die kennis niet machtig zijn, worden de belangrijkste definities en conclusies in omkaderde of vetgedrukte tekstdelen weergegeven. De volledige beschrijving van dit onderwerp is terug te vinden in het onvolprezen boek WATER, a Comprehensive Guide for Brewers van de auteurs John Palmer en Colin Kaminski. Sommige afbeeldingen zijn door mij extra toegevoegd of aangepast, in de hoop dat ze nog duidelijker de mechanismen van de alkaliteit tot uitdrukking zullen brengen.
Restalkaliteit en de maischIn de voorgaande delen in deze serie over water hebben we de waterbronnen, de samenstelling van water behandeld. Hierin werd ook aangegeven dat de pH van het water slechts één stukje van de puzzel is. Om je brouwwater te kunnen doorgronden, dien je zowel de pH van het water te kennen, maar ook nog de compositie van het toegepaste water. De mineralen in het water hebben een veel gewichtiger effect op het maischproces dan de pH van het water. Dit komt doordat deze mineralen een buffersysteem in zich hebben.
Dat betekent dat er meer H+1 of OH-1 ionen nodig zullen zijn voor een verandering van de pH-waarde. Het meten van de pH van water zonder kennis te hebben van de grootheid van het buffersysteem is zoals het meten de spanning van een onbekende batterij. Op gelijke wijze zal het weten van de pH zonder te weten hoeveel bufferstof zich in het water bevindt, ons niet verder helpen een inschatting te kunnen maken van het reageren van de pH in de maisch.
Er is nog een andere groep buffers, de melanoidinen vanuit de mout, die eveneens een aanzienlijk effect hebben op de pH van de maisch. Deze komen voor in meer gekleurde of donkere mouten. Waarom is de pH van de maisch belangrijker dan de pH van water? Omdat de beste bieren worden geproduceerd wanneer een maisch wordt gecontroleerd binnen vrij nauwe marges van temperatuur en pH. pH is het resultaat van een chemisch evenwicht!
Het water en de mouten zijn de nieuwe reactiecomponenten en de maisch-pH is een maat voor het reactieproduct. Hoewel het verwarrend is, is de maisch-pH zowel een factor voor de prestatie van de maisch als het resultaat van die prestatie. Om dit te helpen begrijpen, moet we een stapje terug doen en ons bedenken dat de concentratie aan waterstofionen(de pH) op een bepaald moment het resultaat is van het chemische evenwicht van dat systeem. Daarom zijn de prestaties van het beslag (maisch), d.w.z. optimale enzymactiviteit en omstandigheden die er gunstig voor zijn, ook het resultaat van diezelfde chemie. Daarom kunnen we de enzymactiviteit en de prestatie van de maisch beschouwen als een functie van de pH van de maisch, omdat we een goed begrip hebben van de chemie die dit aandrijft. De pH van het water is op zichzelf geen factor voor de prestatie van de maisch, omdat het de meting is van verschillende en niet-gerelateerde reacties. OK? OK.
Misschien zei David Taylor het het beste in The Importance of pH Control While Brewing[1]: “Het belangrijkste punt voor de controle van de pH tijdens het brouwproces is tijdens het maischen. Dit komt door de grote invloed die in dit stadium kan worden uitgeoefend op de inhoud en het formaat van de buffersystemen die vervolgens in het wort en bier gaan werken.” Dus, wat is de ideale pH voor de maisch? Dat is een heel goede vraag. In een Textbook of Brewing [2] merkt Jean De Clerck op dat de pH van een beslag samengesteld uit basismout met gedestilleerd water ‘normaal ongeveer 5,8’ is. Deze waarde heeft betrekking op de afgekoelde wort. De Clerck merkt op dat de gemeten wort-pH afneemt met toenemende temperatuur, daarbij verwijzend naar het werk van Hopkins en Krause. De pH-afname is ruwweg lineair met de temperatuur en het verschil is 0,34 tussen 18 en 65 °C met gedestilleerd water en 0,33 met ‘gemiddeld hard water’ voor dezelfde temperaturen. Dit betekent dat er een consistente compensatie is tussen de pH van wort bij het maischen en bij kamertemperatuur. Aangezien de meeste technische studies de kamertemperatuur als standaard voor het meten van de pH van wort hebben gebruikt en metingen bij kamertemperatuur vriendelijker zijn voor analytische apparatuur, wordt de kamertemperatuur als standaard toegepast in deze publicatie. De Clerck geeft niet aan wat de optimale maisch-pH is. Hij stelt alleen dat: “de meeste enzymen hun grootste activiteit vertonen bij een pH die lager is dan die van wort, die normaal ongeveer 5,8 is. Daarom wordt het beslag vaak aangezuurd om de pH te verlagen tot 5,0-5,2, wat meer geschikt is voor proteolyse (afbraak proteïnen) en de afbraak van organische fosfaten.” Proteolyse is de biologische ontleding in een organisme van proteïnen via hydrolyse, zowel in de cellen (intracellulair) als erbuiten (extracellulair). Hydrolyse van eiwitmoleculen wordt aangezwengeld door specifieke enzymen, proteasen genoemd. Bij proteolyse komen peptiden en aminozuren vrij, die opnieuw kunnen worden gebruikt. Wolfgang Kunze in Technology Brewing and Malting [3] stelt dat het optimale pH-bereik voor de amylasen en de afbraak van zetmeel 5,5-5,6 is, omdat de totale extract- en verdunningslimiet hoger is in vergelijking met het ‘normale’ pH-bereik van de maisch van 5,6-5,9. Hij geeft aan dat ‘normaal’ afhankelijk is van de mout- en de samenstelling van het brouwwater. Verderop in de tekst stelt hij dat de voordelen van het verlagen van de pH van de maisch een verkorting en optimalisatie van het maischproces, een snellere zuivering, een betere opbrengst, een betere kleurstabiliteit, een betere fermentatie en een beter schuim omvatten. Samenvattend stelt hij dat brouwers de pH moeten regelen, zodat het beslag een pH-bereik van 5,4-5,6 heeft en de uiteindelijke pH van het wort na het koken 5,1-5,2 moet zijn. In pH in Brewing: An Overview [4] merkt prof. Charles Bamforth op dat de optimale pH voor de verschillende proteolytische en sacharificatie-enzymen aanzienlijk lijkt te variëren met het substraat dat door de onderzoekers voor het experiment is gekozen, en suggereert dat de hittestabiliteit van de enzymen belangrijker is hun werkzaamheid dan pH. Bamforth merkt echter ook op dat de pH een sterk effect lijkt te hebben op de extractie van enzymen uit de mout, zoals aangetoond door het werk van Stenholm en Home [5], die aantoonden dat het verlagen van de pH van de maisch van 5,7 naar 5,4 de extractie van limiet dextrinase verhoogde.
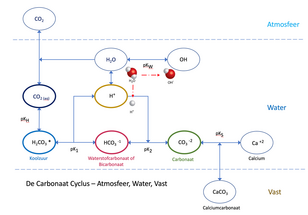
Om deze effecten te illustreren, was de optimale pH van de maisch- of filtratieprestatie 5,5-5,7 in één experiment met calciumzouten versus 4,4-4,6 in een ander experiment met zuurtoevoegingen. Samengevat geven deze bronnen een ‘optimaal’ pH-doelbereik bij kamertemperatuur aan van 5,0 tot 5,6. De lage kant van dit bereik is waarschijnlijk niet zo toepasbaar als het ooit was, aangezien de sterk gemodificeerde mouten van vandaag de behoefte aan proteolyse verminderen. Daarom zou het beoogde pH-bereik van de maisch waarschijnlijk 5,2-5,6 moeten zijn. De brouwer kan echter een waarde binnen dat bereik kiezen die het beste bij zijn bier past. De brouwer moet ook proberen de pH van het beslag te regelen tot een nauwere tolerantie van +/- 0,1 pH om consistentie te verzekeren. Er zijn veel factoren die de pH van de maisch beïnvloeden, en een aantal daarvan is gebaseerd op de gerstvariëteit en het moutproces - factoren die de brouwer doorgaans niet in de hand heeft. Het beste wat de brouwer kan doen, is een consistente, hoogwaardige bron voor de mout vinden en zich richten op de factoren die hij wel kan beheersen, namelijk de samenstelling van het brouwwater, zout- en/of zuurtoevoegingen en consistentie van bemonsterings- en meetmethoden. De belangrijkste factor om het effect van de samenstelling en aanpassing van het brouwwater te begrijpen, is de resterende alkaliteit. Restalkaliteit (RA) is het samenspel van waterhardheid en alkaliteit in het beslag, en dat concept zal hieronder worden gepresenteerd. Water AlkaliteitDe eerste stap om de resterende alkaliteit (RA) te begrijpen, is begrijpen hoe alkaliteit in de eerste plaats in het water terechtkomt. Het is een tweedelig systeem dat wordt geregeld door de druk van het beschikbare kooldioxidegas (CO2) in de lucht.
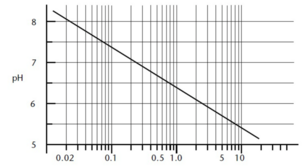
De hoeveelheid carbonaat die in het water kan worden opgelost, hangt af van de partiële druk van kooldioxide die op zijn beurt de hoeveelheid opgeloste kooldioxide in het water bepaalt - met andere woorden, opgelost carbonaat en opgeloste kooldioxide zijn altijd in evenwicht. Of ze proberen dat te zijn; concentraties aan carbonaat in water jagen altijd op veranderingen in opgeloste gehaltes aan koolstofdioxide. In de natuur verloopt dit evenwichtsherstel langzaam en lost calciumcarbonaat (krijt) zeer langzaam op. Dit is in feite de reden waarom carbonaataanslag zo vaak voorkomt op kranen en douchekoppen - de snelle drukdaling en daaropvolgende beluchting als het water wordt afgevoerd, geeft de opgeloste CO2 vrij en laat het water in wezen in een oververzadigde toestand voor carbonaat. Het oververzadigde carbonaat hoopt zich geleidelijk op, op de nabijgelegen oppervlakken. Omgekeerd zal een oververzadigde oplossing van CO2 calciumcarbonaat sneller in water oplossen. Het carboniseren van water met pure CO2 onder hogere druk zal het proces van het oplossen van calciumcarbonaat in water versnellen. Het evenwicht van de carbonaten tot opgeloste kooldioxide bepaalt de pH in zuiver water. Zie afbeelding 5.1. In een echte wereldsituatie zijn er meer factoren die ook van toepassing zijn, maar de partiële druk van CO2 en het resulterende koolstofdioxide/carbonaat-evenwicht zijn de belangrijkste pH-factoren in de meeste drinkwaters. Er zijn verschillende chemische vergelijkingen die het evenwicht bepalen tussen de vaste, vloeibare en gasvormige carbonaatsoorten. Kooldioxidegas lost op in water volgens de wet van Henry, waarbij de concentratie [CO2] wordt bepaald door de partiële druk van het gas, PCO2, in atmosfeer en de constante KH = 0,032: [CO2] = 0,032PCO2. Het opgeloste CO2 is een gehydrateerd oxidemolecuul met twee bijbehorende watermoleculen, zoals calciumsulfaat (CaSO4•2H2O). Het wordt vaak geschreven als CO2 (aq) om het te onderscheiden van gasvormig CO2. En opgelost CO2 is niet hetzelfde als koolzuur - er wordt slechts een klein deel van het koolzuur (H2CO3) gevormd, meestal 0,17% van het totale opgeloste kooldioxide. De combinatie van deze twee vormen, d.w.z. [H2CO3] + [CO2 (aq)], wordt meestal geschreven als ‘H2CO3*’. Het is belangrijk om te begrijpen dat discussies over koolzuur en het lage pH-einde van het evenwicht in feite meestal discussies zijn over waterige CO2, die onderhevig is aan de wet van Henry en de partiële druk van koolstofdioxide. EvenwichtsconstantenNiet alle chemische reacties worden voltooid. Een evenwichtsconstante beschrijft de continue voorwaartse en achterwaartse reacties van een chemische evenwichtsvergelijking. In de reactie A + B ↔ C + D betekent de tweekoppige pijl dat de reactie niet tot voltooiing komt, en dat een deel van A en B reageert om C en D te vormen, en een deel van C en D reageert om A en B. Het evenwicht tussen de twee zijden, bij een gegeven temperatuur en druk, wordt gedefinieerd door de vergelijking [A] [B] / [C] [D] = K, de evenwichtsconstante. De twee belangrijkste reacties in de waterchemie zijn:
Als er waterstofionen bij betrokken zijn en de getallen erg klein zijn, nemen we graag de negatieve logaritme van het getal om het beter beheersbaar te maken, zoals we dat ook doen in het geval van pH, zodat: -log[H+1] = pH en -logK1 = pK1. (P is de negatieve logaritme). In het geval van kalk en water, waar het moedermateriaal het evenwicht domineert (wat betekent dat heel weinig van de stof oplost of reageert), wordt de noemer (ouder) als een constante beschouwd en wordt opgenomen in de K, zodat voor:
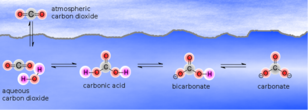
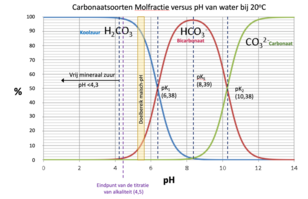
In elk geval stelt de constante je in staat om de concentratie van een onbekende te berekenen, ervan uitgaande dat je de andere hebt gemeten. Het oplossen van krijt in water met waterig CO2 wordt beschreven door de volgende vergelijkingen. Deze chemische vergelijkingen bij 20 ° C worden elk bepaald door evenwichts- of dissociatieconstanten: [CO2] + H2O ↔ H2CO3* pKH = 1,41 Waarbij de algemene reactie aCO2 + bH2O + cCaCO3 ↔ dH2CO3 is en het evenwicht tussen H2CO3* ↔ HCO3-1 ↔ CO3-2 wordt bepaald door pK1 en pK2. Met andere woorden, eenmaal opgelost, kan het carbonaat in drie evenwichtsvormen (soorten) voorkomen, afhankelijk van de pH: waterig kooldioxide/koolzuur (H2CO3*), bicarbonaat (HCO3‑1) en carbonaat (CO3-2). De oplosreacties worden in onderstaande afbeeldingen 5.2. en 5.3. weergegeven. De verhoudingen van de evenwichtsvormen als functie van de pH worden weergegeven in de daarop volgende afbeelding 5.4. Houd er rekening mee dat ‘evenwicht’ betekent dat de soorten voldoende tijd hebben gekregen om een stabiele, evenwichtige toestand te bereiken. Merk ook op dat ‘voldoende tijd’ meestal vele uren is, en dat veranderingen aan de ene soort inderdaad veranderingen in de andere soort zullen veroorzaken, maar dat de verandering die in het diagram wordt aangegeven vaak vele uren in beslag zal nemen.De relatieve verhoudingen van de carbonaatvormen variëren met de pH. De molaire concentraties van CO2/koolzuur en bicarbonaat in water zijn gelijk bij pK1, en de molaire concentraties van carbonaat en bicarbonaat zijn gelijk bij pK2. De bicarbonaatvorm is dominant bij (pK1 + pK2)/2 = 8,3. Beneden pH 4,3 is het carbonaat volledig omgezet in waterig CO2 en koolzuur, en dit gebied (<4,3) zou bestaan uit vrije minerale zuren. In het pH-bereik van de maisch, onder evenwichtsomstandigheden, wordt het aandeel voornamelijk waterig CO2, met een kleiner aandeel bicarbonaat. Onderstaande figuur geeft een visuele weergave van de variatie van deze carbonaatsoorten met pH. Zoals hierboven vermeld, kan de overgang tussen de carbonaatsoorten langzaam plaatsvinden, gedurende vele uren, zelfs in het beslag/de maisch. De oplosbaarheid van het carbonaatsysteem neemt af met de temperatuur, en dit is te wijten aan zowel de verminderde oplosbaarheid van gassen (d.w.z. CO2) in water (vanwege de afname van de Henry-coëfficiënt), als aan een afname van het oplosbaarheidsproduct zelf. De oplosbaarheid van calciumcarbonaat in zuiver water (geen opgeloste CO2) bij kamertemperatuur is slechts ongeveer 14 ppm, hoewel de oplosbaarheid ervan toeneemt tot ongeveer 50 ppm (d.w.z. 1 mEq/L) wanneer het in contact komt met lucht, dat wil zeggen normale druk, en kan oplopen tot 75 ppm met meer opgeloste kooldioxide. De oplosbaarheid van calciumcarbonaat zal licht toenemen in de aanwezigheid van andere zouten die geen calcium of carbonaat bevatten, zoals natriumchloride of magnesiumsulfaat. Deze zouten verhogen de oplosbaarheid enigszins omdat hun ionen de neiging hebben om de calcium- en carbonaat-ionen van elkaar af te schermen, zodat ze minder snel associëren en neerslaan als calciumcarbonaat. Calciumsulfaat neemt ook af in oplosbaarheid bij stijgende temperatuur, maar de oplosbaarheid is orden van grootte hoger bij 3 tot 8 gram per liter. De toevoeging van calciumsulfaat aan water met opgelost calciumcarbonaat zal na verloop van tijd tot neerslag van calciumcarbonaat leiden omdat het extra calciumion het oplosbaarheidsproduct [Ca+2][CO3-2] boven zijn limiet doet stijgen. Hoe ontstaat dan water met een hoge alkaliteit in de natuur? De sleutel is de partiële druk van kooldioxide ondergronds. De partiële CO2-druk onder de grond kan 0,03 tot 0,05 atmosfeer (atm.) bereiken in vergelijking met de normale atmosferische partiële druk van 0,0003 tot 0,0005 atm., voornamelijk als gevolg van bacteriële ademhaling. Wanneer het grondwater naar de oppervlakte wordt gebracht, komt het overtollige CO2 vrij in de atmosfeer. Het herstel van het evenwicht door het neerslaan van het extra calciumcarbonaat gebeurt echter langzaam, zoals blijkt uit de geleidelijke opbouw van kalkaanslag op huishoudelijk sanitair. Als je naar de lage pH van de maisch kijkt, zou je aannemen dat elk alkalisch zout (natriumbicarbonaat, calciumcarbonaat, calciumhydroxide, enz.) gemakkelijk zou oplossen en dat al zijn alkalische potentieel beschikbaar zou zijn om de pH van het beslag te beïnvloeden, indien gekwantificeerd in termen van totale alkaliteit als CaCO3. De praktijk heeft echter uitgewezen dat dit niet het geval is. Neerslag van calciumfosfaten in de maischGemoute gerst bevat ongeveer 1 gewichtsprocent fosfaat en dit is een van de sleutels om de pH van de maisch te verlagen tot het bereik dat wordt begunstigd door de enzymen. Het fosfaat wordt voornamelijk gebonden als moutfytine en wordt tijdens het maischen gehydrolyseerd. Fytine is een gemengd kalium- en magnesiumzout van fytinezuur. Deze hydrolyse wordt (of zou worden) gekatalyseerd door het enzym fytase, maar fytase wordt gemakkelijk gedenatureerd (onbruikbaar gemaakt door een proces waarbij het eiwit/enzym uitvlokt doordat de tertiaire structuur wordt verbroken) door in alle mouten, behalve de lichtste mouten, te eesten. Gelukkig vindt de hydrolyse toch plaats en zijn de verschillende fosfaationen (meestal H2PO4-1, maar ook H3PO4, HPO4-2 en PO4-3) beschikbaar voor reactie met calcium. De chemische reacties in de maisch zijn vrij eenvoudig, maar er zijn minstens tien afzonderlijke, maar van elkaar afhankelijke reacties, die samen de pH verlagen. Deze reacties slaan calciumfosfaten neer, waarbij waterstofprotonen vrijkomen die reageren met opgelost carbonaat (alkaliteit) om water en CO2-gas te vormen, waardoor de alkaliteit van het systeem wordt verminderd. Het neerslag is voornamelijk hydroxylapatiet, Ca10(PO4)6(OH)2, maar kan ook bestaan uit soorten als CaH(PO4), Ca4H(PO4)3, enz. De hoeveelheid CO2 die bij deze reactie wordt geproduceerd, is gelijk aan de vermindering van de alkaliteit van het water omdat alkaliteit wordt gedefinieerd als de hoeveelheid zuur (d.w.z. mEq/l waterstofion) om carbonaat en bicarbonaat om te zetten in koolzuur (H2CO3*). Een samengevatte versie van de reactie is: 10Ca+2 + 12HCO3- + 6H2PO4-1 + 2H2O → Ca10 (PO4)6(OH)2 + 12CO2 + 12H2O + 2H+1
De verlaging van de alkaliteit wordt meestal beperkt door de hoeveelheid calcium die beschikbaar is in het water/beslag. Er zit veel fosfaat in de maisch - met bijna 1% van de mout per gewicht en uitgaande van een water-korrelverhouding van 4 liter/kg, komt dit neer op bijna 2 gram per liter of 2.000 ppm, tegenover het typische calciumgehalte van minder dan 100 ppm in de meeste natuurlijke waterbronnen. Rest AlkaliteitEn nu om het allemaal samen te brengen: Hoe beïnvloeden carbonaatoplosbaarheid, alkaliteit en waterhardheid samen de pH van de maisch? Het antwoord is een hoeveelheid die ‘restalkaliniteit’ wordt genoemd. In 1953 voerde de Duitse brouwwetenschapper Paul Kolbach [6] een reeks experimenten uit op een aantal batches wort samengesteld uit basismout waarin hij vaststelde dat:
Verder stelde hij vast dat magnesium op een vergelijkbare manier werkte, maar in mindere mate vanwege de hogere oplosbaarheid van magnesiumhydroxide, waarbij
Per volume kan dit worden uitgedrukt als: mEq/L RA = mEq/L Alkaliteit - [(mEq/L Calcium)/3,5 + (mEq/L Magnesium)/7] waarbij mEq/L wordt gedefinieerd als milli-equivalenten per liter. Er kan een andere equivalente eenheid worden gebruikt, zoals ‘als CaCO3’, maar niet simpelweg de concentratie als ppm – er moet rekening worden gehouden met de chemische equivalentie. Deze vergelijking kan worden herwerkt in meer bekende eenheden als: RA (ppm als CaCO3) = Alkaliteit (ppm als CaCO3) - [(Ca (ppm)/1,4) + (Mg (ppm)/l,7)] of anders weergegeven:
Historisch gezien zijn donkere bierstijlen ontstaan in regio's met een hogere resterende alkaliteit van water, omdat de natuurlijke zuurgraad van de donkere mouten hielp de alkaliteit van het water te neutraliseren, waardoor de opbrengst en smaak van het bier verbeterden. Het brouwen van een donker bier met water met een lage RA kan resulteren in een maisch-pH van 5 of minder, waardoor een meer eendimensionale graanachtig of geroosterde smaak ontstaat en zelfs de bèta-amylase-activiteit wordt aangetast. Van bèta-amylase wordt gerapporteerd dat het een relatief smal bereik heeft in het gebied (5,0-6,0 pH) waar het voorkeur voor heeft. De vergistingsgraad van het wort kan worden verhoogd en de body van het resulterende bier kan worden verminderd. Een lage pH van de maisch kan uiteindelijk bijdragen aan een lage pH van het wort in de maischketel. Een lage wort-pH kan het hopgebruik verminderen en de hopexpressie en bitterheid verminderen.
Deze voorwaarde resulteert ook in een meer eendimensionaal karakter, waarbij het moutkarakter wordt omschreven als ‘saai’. Deze hoge maisch-pH kan vervolgens bijdragen aan een hoge wort-pH in de maischketel. De hoge wort-pH kan ook het hopkarakter veranderen. Hoewel een hogere wort-pH een betere isomerisatie van de hop-alfazuren mogelijk maakt, is de resulterende bitterheid anders - brouwers zeggen dat het verschil een ander bier oplevert, een bier dat smaakt alsof het is gebrouwen met een andere, hogere alfavariëteit. De hogere pH van het wort kan meer polyfenolen uit de hop halen om het ruwere hopkarakter te creëren. Residuele alkaliteit is al tientallen jaren bekend en wordt door Europese brouwers gebruikt, maar het overwicht van het brouwen van pilsbier heeft het gebruik van het concept beperkt.
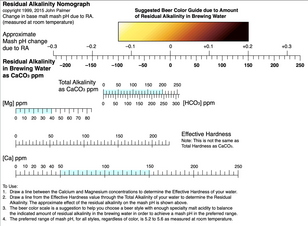
De heropleving van de variatie in bierstijlen bij het ambachtelijk brouwen heeft ervoor gezorgd dat brouwers zijn gaan kijken naar hoe zowel lichte als donkere klassieke bierstijlen zijn ontstaan met betrekking tot de lokale watervoorziening. In zijn paper Brewing Water-Overview [7] zette A.J. de Lange de RA van verschillende van de belangrijkste brouwerijsteden van de wereld uit en merkte op dat een hogere RA in het algemeen gecorreleerd was met donkere lokale bierstijlen. John Palmer onderzocht dit concept in zijn boek How To Brew [8] en ontwikkelde een nomogram die een reeks bierkleuren voorstelde voor een reeks resterende alkaliteit. Het doel van dit werk was om een brouwer in staat te stellen zijn lokale water en zouttoevoegingen of andere behandelingen te gebruiken om de beoogde pH van de maisch/beslag te bereiken met elk recept, licht of donker, en daardoor te helpen een optimale pH in het uiteindelijke bier te bereiken - waar de veelheid aan smaken het best tot uiting komt. Zie afbeelding 5.
Verfijning van RAMeer recent werk van Troester [9] heeft het werk van Kolbach gevalideerd, maar heeft ook gewezen op factoren waar deLange en Palmer geen rekening mee hebben gehouden, met name de maischdikte en de mate van malt crush bij het malen/schroten. Nadere bestudering van Kolbachs artikelen laat zien dat de experimenten werden uitgevoerd op 12°P (1.048 SG) wort na het maischen en spoelen, in tegenstelling tot de maisch zelf. Kolbach stelde vast dat de relatie tussen een pH-verschuiving van gedestilleerd water en 1 mEq alkaliteit 0,084 pH•L/mEq of 11,9 mEq/(pH•L) was of ongeveer 595 ppm resterende alkaliteit als CaCO3/ (pH•L). Troester voerde een reeks maischexperimenten uit met verpulverd koren, waaruit bleek dat de helling of buffercapaciteit van de maisch varieerde als functie van de verhouding tussen water en graankorrels. Er werden testmaisches uitgevoerd op drie alkaliteitsniveaus (0, 2,7, 5,3 mEq/L) voor Weyermann Pilsner-mout (2,77-3,31 EBC) en Malteries Franco-Belges Light Munich-mout (14,5-19,85 EBC) het bereik van korrelverhoudingen van 2-5 liter/kg. Berekeningen van de buffercapaciteit voor verschillende korrelverhoudingen staan vermeld in Tabel 5. De resultaten van Troester's werk geven aan dat de Kolbach-coëfficiënt gelijk zou zijn aan een maischkorrelverhouding van bijna 5 liter/kg, wat consistent zou zijn met een gespoeld wort van 12°P en een typische initiële korrelverhouding van bijna 4. De maisch-pH/restalkaliniteit-nomograaf in Palmer's How To Brew gebruikt de Kolbach-waarde (11,9 mEq/(pH•kg), evenals deLange.
Ook de mate van verbrijzeling van het koren (de fijnheid van het schrootsel) werd door Troester als een factor bepaald. De eerdere gegevens werden verkregen door verpulverd koren te gebruiken. Hij herhaalde het experiment met drie soorten water (0 - 2,9 - 5,7 mEq/L) met verschillende maalopeningen die overeenkomen met de normale commerciële instellingen voor schrootmolens met meerdere walsen: (verpulverd), 0,5 - 0,8 en 1,2 mm. De instelling van 0,8 mm op een molen met twee walsen komt waarschijnlijk het meest overeen met de grove maaltoestand van de American Society of Brewing Chemists (ASBC), die niet wordt bepaald door de afstand tussen de walsen, maar door 75% van een moutmonster dat achterblijft op een zeef nr. 30 (zeefopening van 0,0232 inch). De gegevens toonden aan dat de buffercapaciteit van de verschillende beslagen/maischen afnam met toenemende grootte in spleet tussen de walsen, in ongeveer dezelfde grootte als voor de verhouding korrel/water. Er wordt echter gespeculeerd dat dit effect zou afnemen met een langere maischtijd, omdat het maalsel volledig gehydrateerd wordt en er meer fosfaten beschikbaar zijn voor reactie. Zie Tabel 2.
Nog even de belangrijkste punten uit dit hoofdstuk
Referenties
Vertaald, bewerkt en aangevuld door Jan Wurpel |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Terug naar overzicht | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||