Artikelen
| Terug naar overzicht | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieper in het water gedoken (4) |
tww september 2023 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Door: Jan Wurpel
Door: Jan Wurpel
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Het lezen van een waterrapportHet oude gezegde “als je water goed smaakt, is het prima om ermee te brouwen” kan een gezegde zijn dat werkt voor een niet al te kritische thuisbrouwer, maar een professionele brouwer of een gepassioneerde amateur-brouwer kan de watersamenstelling niet negeren. Hoewel het waar is dat slecht smakend water slecht smakend bier zal opleveren, is het omgekeerde niet altijd waar. Waterchemie is ingewikkeld, maar we hebben voldoende informatie nodig om te begrijpen hoe geschikt brouwwater samengesteld dient te zijn. Het analyseren van de samenstelling van je beschikbare watervoorziening is een essentiële eerste stap. Zoals reeds in het tweede deel is aangegeven is water is een polair oplosmiddel, wat betekent dat elk watermolecuul polen heeft, of negatief en positief geladen uiteinden. De waterstofkant van het molecuul is positiever geladen dan de zuurstofkant, vanwege de elektronenverdeling. Door de polariteit van het molecuul kan het andere polaire moleculen aantrekken, zoals natriumchloride, calciumsulfaat en calciumcarbonaat. Polaire moleculen dissociëren (splitsen) vaak in positieve en negatieve ionen onder invloed van een polair oplosmiddel. In onderstaande tabel worden een aantal van deze ionen weergegeven.
Wat is een ion?Een ion is een atoom of een groep atomen met een netto positieve of negatieve lading als gevolg van het verlies of de winst van elektronen. Een ion kan positief of negatief geladen zijn door respectievelijk een tekort of een overschot van een of meer elektronen. Een ionische verbinding is een polair molecuul dat bestaat uit 2 of meer ionen die bij elkaar worden gehouden door ionische bindingen (d.w.z. elektrostatische aantrekking). De elektrische lading van een ion wordt aangegeven als een superscript na het chemische symbool voor het ion. In de natuur- en de sterrenkunde beschouwt men meestal geïsoleerde atomen of moleculen; in de scheikunde en de biologie bevinden de geladen atomen en moleculen zich doorgaans in een waterige oplossing (elektrolyt). In dat laatste geval spreekt men van een kation als het ion positief geladen is. Als het negatief geladen is spreekt men van een anion (uitgesproken als “an-ion"). Zo lost het mineraal natriumchloride, ook bekend als keukenzout, (NaCl) op in het kation Na+1 en het anion Cl-1. Het gehydrateerde mineraal calciumchloride (CaCl2•2H2O) valt uiteen in 1 Ca+2, 2 Cl-1 en 2 watermoleculen. Merk op dat de som van de positieve en negatieve ladingen voor alle ionisatieproducten van een enkele verbinding altijd nul is. Bijvoorbeeld, de +2 lading van het calcium en de twee -1 ladingen van de chloride-ionen zijn opgeteld tot nul. Dit is ook een goed punt om te stellen dat de som van de opgeloste kationen en anionen in een natuurlijke watervoorziening ook nul moet zijn. Parameters van een rapport over de waterkwaliteitVeel mineralen en verbindingen komen van nature voor in water en lossen op in de oplossing uit verschillende milieubronnen. Ook de mens levert hieraan een bijdrage die echter veelal ongewenst is. We spreken dan van verontreiniging. Verontreinigingen kunnen ook natuurlijk zijn: schimmels, bacteriën, nitraten, enz. zijn allemaal van nature voorkomende waterverontreinigingen. Het belangrijkste doel van waterbehandeling is het verwijderen van deze verontreinigingen en het doel van een rapport over de waterkwaliteit is om het publiek te informeren over de soorten en gehaltes van deze stoffen in de watervoorziening. We beginnen onze beoordeling van een waterrapport met het identificeren van de belangrijkste bestanddelen: de belangrijkste ionen, chemicaliën en verbindingen in typische drinkwatervoorzieningen. Rapporten over de waterkwaliteit richten zich op hoe het water voldoet aan de wetten voor veilig drinkwater voor verontreinigingen zoals pesticiden, micro-organismen en giftige metalen. Hoewel de primaire normen belangrijk zijn voor het waarborgen van de waterkwaliteit, zijn we als brouwers meestal meer geïnteresseerd in de secundaire of esthetische drinkwaternormen. Secundaire normen zijn richtlijnen voor parameters die van invloed zijn op smaak, pH en de gehaltes aan carbonaten. Deze laatste is bepalend voor de alkaliteit van het water. De bron van de openbare watervoorziening kan op bepaalde plaatsen per seizoen veranderen en dit kan een verschil maken in het karakter van leidingwater als brouwwater.
Van de parameters die van belang zijn voor brouwers, zijn de belangrijkste ionen die van invloed zijn op de prestaties van het brouwwater bij het maischen en fermenteren calcium (Ca+2), magnesium (Mg+2) en de totale alkaliteit als CaCO3, dat soms eenvoudig maar onvoldoende wordt vermeld als bicarbonaat (HCO3-1). Hun interactie in de maischketel, kookketel en fermentor beïnvloeden de pH en andere factoren tijdens het brouwproces. Natrium (Na+1), chloride (Cl-1) en sulfaat (SO4-2) kunnen de smaak van zowel water als bier beïnvloeden, maar hebben over het algemeen geen invloed op de pH of fermentatieprestaties zoals de eerste drie hierboven genoemde ionen. Concentraties ionen in water worden meestal weergegeven als delen per miljoen (ppm) of milligram per liter (mg/l), wat over het algemeen equivalent is in verdunde oplossingen zoals drinkwater, waarvan één liter ongeveer één kilogram weegt.
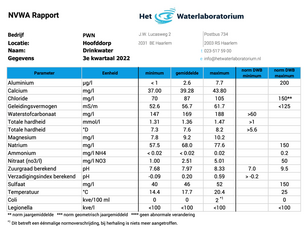
Niet-gereguleerde normen zijn industrierichtlijnen. DrinkwaterbedrijvenNederland telt tien drinkwaterbedrijven: Waterbedrijf Groningen (WBG), Waterleidingmaatschappij Drenthe (WMD), Waterleidingbedrijf Noord-Holland (PWN), Waternet, Dunea, Evides, Oasen, Vitens, Brabant Water en WML. Zij zorgen voor schoon en veilig water uit de kraan. Dat doen ze door grond- en/of oppervlaktewater te winnen, te zuiveren en via een leidingnet aan de klant te leveren. De drinkwaterbedrijven in Nederland produceren jaarlijks meer dan 1 miljard m3 drinkwater. RegelgevingDe Drinkwaterwet (Dww) en de onderliggende regelgeving reguleren onder meer de productie en de distributie van drinkwater door drinkwaterbedrijven. De wet bevat regels voor de kwaliteit, de leveringszekerheid en de bedrijfsvoering. In het Drinkwaterbesluit (Dwb) en de Drinkwaterregeling zijn respectievelijk de normen voor de kwaliteit van drinkwater voor menselijke consumptie en de vereisten voor monitoring en analyse opgenomen. Deze zijn gebaseerd op de Europese Drinkwaterrichtlijn. MeetprogrammaAlle drinkwaterbedrijven voeren een meetprogramma uit ter controle van de kwaliteit van het geleverde drinkwater. Het aantal metingen is gekoppeld aan de hoeveelheid drinkwater die ze dagelijks binnen een leveringsgebied produceren of distribueren. De drinkwaterbedrijven rapporteren de resultaten van het meetprogramma aan de ILT. Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) verzamelt en bewerkt de resultaten voor de ILT. Hiervoor gebruikt het RIVM het programma Registratieopgaven van drinkwaterbedrijven (REWAB). Eigen winningenOok eigenaren van collectieve watervoorzieningen (eigen winningen) moeten een meetprogramma uitvoeren. De ILT houdt toezicht op de kwaliteit van het drinkwater dat deze eigenaren produceren en leveren. Eigen winning is geen onderdeel van deze rapportage. Hieronder een voorbeeld van een waterrapport van ‘Het Waterlaboratorium’ van het water dat het PWN Waterleidingbedrijf Noord-Holland (PWN) levert aan het waternet Hoofddorp. Secundaire normen vanuit de regelgeving in de USASecundaire maximale verontreinigingsniveaus, Engelstalig: Secundary Maximum Contamination Level (SMCL). AluminiumSMCL = 0,2 ppm Chloride (ion)SMCL = 250 ppm KoperSMCL = 1 ppm IJzerSMCL = 0,3 ppm MangaanSMCL = 0,05 ppm SulfaatSMCL = 250 ppm ZinkSMCL = 5 ppm CalciumRichtlijn voor brouwwater = 50 – 150 ppm Calcium is in essentie smaakneutraal maar het kan de soms wat zure gewaarwording van magnesium reduceren. De aanbevolen concentratie aan calcium in het brouwwater is 50 – 150 ppm. Maar bier kan ook succesvol worden gebrouwen met meer of minder dan dit voorgestelde gebied. Oxalaat is aanwezig in gerstemout en reageert met calcium om biersteen te vormen. Calciumoxalaat kan op ieder punt in het brouwproces neerslaan, maar is in het bijzonder een probleem als het neerslaat in de fles of in het vat omdat de kristallen Calciumoxalaat werken als plaatsen waar gasvorming ontstaat en veroorzaakt overmatig schuimen en gushing. Het wordt aanbevolen om voldoende Calcium te hebben (d.w.z. 3 keer meer dan de oxalaat in de mout) om de neerslag eerder in het proces in gang te zetten, zoals in de maischketel of de kookketel in plaats van tijdens de fermentatie of in de verpakking. Calcium en magnesium concentratie worden vaak aangemerkt als zijnde tijdelijke en permanente hardheid. Tijdelijke hardheid kan worden weggenomen door te koken of met kalk verzachting, waar het zich combineert met bicarbonaat om dan neer te slaan als Calciumcarbonaat. CaCO3. Dit is de oorsprong van de eenheid. Als de alkaliteit als CaCO3 groter is dan de hardheid “als CaCO3” dan is alle hardheid tijdelijk. Als de hardheid “als CaCO3” groter is dan de alkaliteit als CaCO3 dan blijft een deel van de hardheid over na het koken en dat staat bekend als blijvende hardheid. Andere processen om calcium te verwijderen zijn ionen uitwisseling en omgekeerde osmose. MagnesiumRichtlijn voor brouwwater = 0 – 40 ppm FosfaatRichtlijn voor brouwwater = onbepaald (maar dient laag te zijn). Fosfaten vormen geen deel van de standaard richtlijnen voor bronwater, maar ze kunnen zowel een vervuiling voor het water zijn als een gebruikelijke toevoeging bij de waterbehandeling. Vervuiling komt meestal van de uitspoeling van agrarische oorsprong en industrieel afval en kan worden behandeld met aluminium- of ijzerzouten door het onoplosbaar te maken en het daarna uit te filteren. Fosfaatverbindingen overheersen in de mout en het wort. Hoge niveaus aan achterblijvende fosfaten zijn normaal in het afvalwater van de brouwerij en dit kan behandeld worden, op zowel aerobe als anaerobe wijze. Fosfaten kunnen ook verwijderd worden d.m.v. ionen uitwisseling, of omgekeerde osmose processen. KaliumRichtlijn voor brouwwater = < 10 ppm. Het vermogen om op te lossen van Kaliumzouten lijkt erg op die van Natrium, maar komt veel minder voor in natuurlijke watervoorzieningen. Hoge niveaus aan Kalium in bronwater kan veroorzaakt worden door overmatig slib, d.w.z. water met een hoge troebelheid. Kaliumionen kunnen naar zout smaken bij concentraties die hoger zijn dan 500 ppm. Wort en bier hebben relatief hoge natuurlijke concentraties aan Kalium (300 – 500 ppm), die door de mout wordt bijgedragen. Daarom is water dat verzacht is met Kalium potentieel net zo gevaarlijk als brouwen met water dat verzacht is met Natrium. Echter, het is te verkiezen boven natriumzouten als middel om het aantal kationen in het bier te verhogen indien de initiële hoeveelheden mout dit toestaan. Kalium kan worden verwijder d.m.v. omgekeerde osmose. NatriumRichtlijn voor brouwwater = 0 -50 ppm. Natrium kan in zeer hoge niveaus in drinkwater voorkomen, in het bijzonder als het water zachter is gemaakt met een op zout gebaseerde (Ionen uitwisseling) verzachter. In het algemeen is water dat zacht gemaakt is niet geschikt voor het brouwen, hoewel in zeldzame gevallen gecontroleerde verzachting zinvol is om ijzer en magnesium te verwijderen, ondanks een verhoging van Natrium. Voor niveaus aan Natrium van 70 - 150 ppm, maakt het de smaak van het bier ronder en accentueert het de zoetigheid van de mout, vooral in samenwerking met chloride-ionen. Natrium draagt bij aan een zoute smaak bij concentraties van 150 – 200 ppm en kan wrang en zuur gaan smaken als de concentratie de 250 ppm overstijgt. Brouwen met lagere concentraties zal over het algemeen een schonere smaak in het bier opleveren. De combinatie van een hoge concentratie aan Natrium en sulfaationen zal een zeer wrang, zuur/ bittere minerale smaak opleveren. Totaal Opgeloste stoffen [Total Disolved Solids] (TDS)SMCL = 500ppm. Richtlijn voor brouwwater = < 500 ppm. Het totaal aan opgeloste stoffen (Total Dissolved Solids) is wat overblijft als al het water verdampt. Sommige zijn zouten, sommige zijn organische stoffen en sommige zijn chemische residuen. Het totaal aan opgeloste stoffen is behulpzaam voor industriële doeleinden, maar is niet erg belangrijk voor de beschrijving van geschikt brouwwater. De indicator van het totaal aan opgeloste stoffen is een snelle indicator voor de mate van het gemineraliseerd zijn van de potentiële waterbron. Algemeen geldt dat water met een hoge TDS de neiging heeft om meer carbonaat af te zetten (aanslag te produceren) dan water met een lage TDS. Water met een hoge TDS heeft de neiging om meer corrosief te zijn dan water met een lage TDS, ofschoon de mate van corrosie sterk afhangt van de specifieke materialen die worden gebruikt. Het monitoren van TDS van een waterbron d.m.v. een (elektrische) geleidingstest is een goede manier om alert te kunnen zijn op plotselinge verandering in de waterbron. Het testen van het totaal aan vaste stoffen (TDS)Het totaal aan vaste stoffen van water wordt bepaald in het laboratorium. Een watermonster wordt gefilterd om alle zwevende materialen te verwijderen die de test zouden kunnen scheef trekken. Een afgemeten volume van het gefilterde water, verwarmd totdat alle vocht verdampt is en de eerder opgeloste stoffen achterblijven. De massa hiervan wordt gemeten en gedeeld door de hoeveelheid van het oorspronkelijke watermonster om het resultaat te kunnen bepalen, en wordt meestal uitgedrukt in milligrammen per liter (mg/L). In verdunde oplossingen voor drinkwater, is de mg/L doorgaans equivalent aan pats per million (ppm). TDS Kan ook worden geschat via de (elektrische) geleidingskarakteristieken van water. Een speciale meter wordt gebruikt om de geleiding van de oplossing te meten. Die geleidingswaarden kunnen worden gecorreleerd aan een schatting van de hoeveelheid TDS in de oplossing met de volgende vergelijking: TDS (pmm) = Geleiding (µS/cm) X F Waarbij F een conversiefactor is die gewoonlijk varieert tussen 0,54 en 0,96, met een meest voorkomende waarde van 0,67. De geleiding wordt gemeten in micro Siemens (µS) per cm of micro-mho’s per cm. (Mho is hierbij het omgekeerde van Ohm, wat gewoonlijk de weerstand betekent die een elektrische stroom ondervindt.) TDS meters die een directe uitlezing verschaffen zijn geleidingsmeters die de conversie vergelijking al in zich hebben TDS meters kunnen een waardevolle check op de waterkwaliteit opleveren op binnenkomend kraanwater of op de effectiviteit van waterbehandeling in de zin van water demineralisatie processen (RO, Nano filtratie, enz.). GeleidingsvermogenRichtlijn voor brouwwater = onbepaald. Specifieke geleiding of geleidingsvermogen is een maatstaf van het algemeen vermogen van een oplossing om een elektrische stroom te geleiden en hangt af van zowel het type als de hoeveelheid van de opgeloste substanties. Het werkt niet bepaald goed om verschillende waterbronnen met elkaar te vergelijken, maar het is zinvol voor het meten van variaties in één enkele waterbron, omdat het gecorreleerd kan worden aan TDS. Zuiver water is een isolator en geleid daarom geen stroom, maar wordt licht losgekoppeld bij een pH van 7 en heeft de neiging een geleiding te vertonen van 1 micro-Mho/cm. ( De grootheid Mho is het omgekeerde van een Ohm – de eenheid van elektrische weerstand. Totale alkaliteitRichtlijn voor brouwwater = < 100 ppm De alkaliteit is bediscussieerbaar de meest belangrijke parameter voor de brouwer, omdat het het grootste effect heeft op de prestatie tijdens het maischen.
Afhankelijk van de begin pH van het watermonster, kunnen zowel de carbonaat alkaliteit en de porties bicarbonaat van de alkaliteit deel zijn van de titratie en de som definieert de totale alkaliteit. Als de begin pH van het water hoger is dan 8,3, wordt de carbonaat alkaliteit gedefinieerd als de hoeveelheid zuur die benodigd is om de pH naar 8,3 te titreren. Dit wordt aangeduid als de P-alkaliteit en wordt doorgaans gemeten door gebruik te maken van een indicator op basis van oplossing met fenolftaleïne. Als de begin pH van het water lager is dan 8,3, is de bijdrage aan carbonaat niet veelzeggend en wordt het watermonster doorgaans getitreerd door gebruik te maken van een methyl oranje indicator welke een kleurgebied heeft van 3,2 tot 4,4 pH. Dit, door bicarbonaat gedomineerde deel van de titratie, wordt M-alkaliteit genoemd. De totale alkaliteit is de som van P-alkaliteit en M-alkaliteit. Het totale volume aan zuur dat nodig is om het eindpunt van de pH van 4,3 te bereiken wordt geconverteerd tot mEq/liter en vermenigvuldigd met het equivalent van 50 om de typische eenheid “totale alkaliteit, ppm als CaCO3" te verkrijgen. Maar, van de methyl oranje kleur verandering dat het 4,3 pH eindpunt bepaald wordt gezegd dat dit te fijn en moeilijk is om dit accuraat te observeren. De huidige ISO standaard specificeert het gebruik van de broomcresolgroen-methyl rood indicator oplossing, waarvan het eindpunt gedefinieerd is op 4,5 pH. Het besluit om welk pH eindpunt te verkiezen is aan het laboratorium, maar de ISO standaard is 4,5 pH. Het verschil in de beide methoden van het berekenen van het eindpunt verschilt niet veel, en bedraagt ongeveer 5%. De nauwkeurigheid is waarschijnlijk beter dan de resolutie van de meeste druppelaartesten die gebruikt worden bij aquaria en zwembaden, en is vergelijkbaar met de fout die potentieel geïntroduceerd wordt in het laboratorium bij het meten van de volumes van het monster en de reagentia. Het zoeken van contact met een laboratorium wordt aanbevolen als het eindpunt of indicator niet is gespecificeerd in het resultaat van de alkaliteit. Totale hardheidRichtlijn voor brouwwater = 150 – 500 ppm als CaCO3
Waarbij de vierkante haakjes [ ] de concentratie van de soorten ionen, in ppm, weergeeft Deze vergelijking converteert de individuele concentratie als de als CaCO3 equivalent. Andere bivalente ionen zoals ijzer, mangaan, chroom, zink, etc., leveren eveneens een bijdrage aan de hardheid, indien die in aanzienlijke hoeveelheden aanwezig zijn, en zullen worden daarbij worden opgeteld op een gelijke manier. Calcium en magnesium zijn de meest heersende stoffen in de hardheid van drinkwater. Wat is een MOLDe term “MOL” is afgeleid van “gram molecuul” en wordt gebruikt om een gelijke hoeveelheid chemische “dingen” te beschrijven door hun atomen of moleculen (of ionen of elektrische ladingen). Het is toepasbaar voor chemici voor het aanduiden van de hoeveelheden van “dingen” die betrokken zijn bij een chemische reactie. Daarom kunnen we zeggen dat 2 MOL waterstof reageren met 1 MOL zuurstof om 1 MOL water te vormen. Het interessante is dat de mol ontwikkeld werd met de komst van atomaire theorie en wetenschappers probeerden de atoommassa te kwantificeren. Er waren toen ten minste 3 kandidaten om tot standaard gekozen te worden, namelijk Waterstof, Zuurstof en Koolstof. Uiteindelijk werd het isotoop Koolstof 12 gekozen, en de MOL werd gedefinieerd als het aantal atomen in 12 gram koolstof. Daarvoor is het “getal van Avogadro” gedefinieerd als het aantal atomen in 1 MOL Koolstof 12, en dit aantal werd experimenteel bepaald op 6, 02214078 X 1023 +/- 1,8 X 1017. Een isotoop van een element heeft het zelfde aantal protonen in z’n kern als het moederelement, maar een verschillend aantal neutronen. Isotopen zijn gedefinieerd door het totaal aantal protonen en neutronen in de kern. Als voorbeeld hier de nomenclatuur Koolstof 12 wat betekend dat het atoom 6 neutronen bevat bovenop de 6 protonen, aangeduid bij z’n atoomnummer 6. Waterhardheid, Alkaliteit en Milli-equivalantenHardheid en alkaliteit van water worden vaak uitgedrukt “als CaCO3” omdat wanneer 100 mg calciumcarbonaat in 1 liter water wordt opgelost, gebruik makend van koolzuur (de weg imiterend zoals de natuur kalksteen oplost) zal de calciumhardheid en alkaliteit (zoals met de standaard methoden gemeten wordt) elk 100 ppm bedragen. De hardheid van water wordt in waterkwaliteitsrapporten veelal weergegeven als “Hardheid als CaCO3 of Totale Hardheid en is gedefinieerd als de som van de concentraties van calcium en magnesium ionen in Milli-equivalenten per liter (mEq/l), vermenigvuldigd met 50 (het equivalente gewicht van als CaCO3). De hardheid van water wordt vaak gemeten met een chelaat vormende test (chelaat = Molecuul dat op twee plaatsen met een metaal bindt, of verbinding van een organische stof (chelator) met metaalionen.) waarin een chemisch middel zoals EDTA wordt gebruikt om alle kationen te binden en te doen neerslaan vanuit een oplossing. Deze massa wordt gewogen, en dat gewicht per volume is de totale hardheid voor de oplossing. IJzer, Mangaan en andere metalen kunnen eveneens worden geteld in de chelaat vormende test, zodat het getal van de totale hardheid in het waterrapport vaak groter is dan de som van Calcium en Magnesium als CaCO3.
Als het ion een grotere lading bezit (bijv. 2), dan wordt 1 MOL van die stof gedefinieerd als (2) equivalenten. Daarom is een equivalent gewicht van een stof gelijk aan het MOL gewicht, gedeeld door het aantal equivalenten die het verschaft. Doorgaans is het aantal equivalenten van een stof gelijk aan diens lading van de valentie-electronen, zoals in het geval van Calcium, hoewel sommige stoffen laden met pH.
Equivalente gewichten zijn de sleutel voor het begrijpen hoe de concentratie aan Calciumionen in ppm zich verhoudt tot het getal van de “Totale Hardheid als CaCO3”. De omzettingsfactor is het equivalent van de stof. Het concept van equivalenten en equivalent gewicht wordt ingewikkelder met andere stoffen zoals koper en ijzer-elementen die een aantal verschillende oxidatietoestanden kennen (bijv. CU+1, CU+2, en Fe+2, Fe+3). Deze elementen elk hebben twee equivalente gewichten, afhankelijk van de andere stoffen in de reactie. Maar dat valt even buiten de beschouwing. Als een voorbeeld nemen we de berekening van de totale hardheid als CaCO3 van een watermonster van de concentratie kationen waarvan je de hoeveelheden ppm eerst moet converteren naar equivalenten. (Eigenlijk milli-equivalenten, aangezien een equivalent doorgaans gemeten wordt in MOL’s (d.w.z. grammen) per liter, en parts per miljoen zijn gram per liter. Dus, de eerste stap is om zowel de Ca als de Mg ion concentraties in ppm te delen door hun equivalente gewicht, wat hun concentraties in milli-equivalenten per liter oplevert. De conversiefactor tussen de Calcium hardheid en Calciumcarbonaat hardheid is de omgekeerde verhouding tot de equivalenten van hun gewicht, d.w.z. 50/20. Aangezien de totale hardheid als Calciumcarbonaat wordt gedefinieerd als zijnde de som van de Calcium hardheid en de Magnesium hardheid, worden de milli-equivalenten van Calcium en Magnesium bij elkaar opgeteld, en met 50 vermenigvuldigd (het equivalente gewicht van CaCO3 om de totale hardheid als milli-equivalenten per liter als CaCO3 te verkrijgen. Vergelijkbare conversiefactoren zijn samengevat in bovenstaande tabel. Om het samen te vatten, er kunnen honderden stoffen zijn in de watervoorziening, maar slechts een paar dozijn hebben een betekenis voor de brouwer. BronnenDe tekstdelen zijn voor een groot deel vertaald en bewerkt vanuit het boek ‘Water, a Comprehensive Guide for Brewers’ van John Palmer en Colin Kaminsky, met de volgende referenties aan geraadpleegde literatuur:
De kwaliteit van het drinkwater in Nederland in 2016. Inspectie Leefomgeving en Transport ILT/Water, Producten en Stoffen |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Terug naar overzicht | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||