Artikelen
5 artikelen uit het clubblad van September 2023
| Terug naar overzicht | |||||||||||||||||||||
Wie heeft een passie voor bottelen? |
tww september 2023 | ||||||||||||||||||||
| Door: Marco Pipolo | |||||||||||||||||||||
|
Om tijd te besparen, opslagruimte te verminderen, meer consistentie te hebben met koolzuur en afval te verminderen, hebben we in februari 2022 besloten om onze eigen ‘koelkast-tapstation’ te bouwen. In ons geval was vanwege de beperkte ruimte een verticale koelkast van 346L perfect. We hebben besloten om 3 lijnen te maken waar in totaal 3 fusten van 19 l, 3 fusten van 9 l en de CO2 fles in past. We gebruiken zelden alle lijnen tegelijk, maar voor feesten is het geweldig om ze te hebben. De totale investeringskosten voor ons waren ongeveer 1230 euro, waarvan:
Al met al goedkoper dan een tapstation dat op de markt te vinden is, dit vanwege het volume van bier dat in een grote koelkast past vergeleken met een kleine kant en klare ‘kegerator’. Het was relatief eenvoudig en het geeft meer voldoening om het zelf te maken. Wij brouwen rond 500 liter bier per jaar, wat hetzelfde is als 63 x 24 flessen van 0.33 liter. Dit zou een waarde hebben in de huidige markt van EUR1246. Het zou dus iets kunnen besparen als de investering eenmaal is gedaan om het bier voor thuisconsumptie in fusten te doen. Natuurlijk ook niet heel onbelangrijk is dat het veel tijd scheelt met bottelen, omdat een fust nu eenmaal sneller gevuld is en minder tijd kost om schoon te maken dan dezelfde hoeveelheid liters bier in een fles. Over het algemeen serveren we bier bij 5-6 °C, daarom doen we 2-3 dagen geforceerde carbonisatie bij 5 °C met 1,5 bar. Dit heeft het bier ook nodig om tot deze temperatuur te komen, tenzij het bier in het fust al koud is, dan kan 1-2 dagen voldoende zijn. Om het proces te versnellen kan de CO2 ook vanaf de onderkant van het fust worden ingebracht (op de kop houden bij het inbrengen van de CO2) en/of het fust een beetje schudden. Hierbij is dezelfde hoeveelheid CO2 nodig, dus geen grote winst, maar de CO2 zal sneller in het bier worden opgenomen, handig als het bier binnen 24 uur nodig is. Heel belangrijk om rekening mee te houden is de serveerdruk, deze hangt sterk af van de lengte en diameter van de lijnen. Een te korte lijn kan resulteren in bier dat moeilijk te schenken is omdat er zeer weinig druk nodig is vanwege lagere drukvallen. In ons geval hebben we gekozen voor 1,5 m x 6 mm, waarvoor slechts een kleine hoeveelheid CO2 nodig is, ongeveer 0,3 bar. Iets meer lijnlengte hebben helpt ook bij het schoonmaken, dus de deur van de koelkast staat open terwijl het fust buiten staat. De CO2 flessen kunnen tegelijkertijd op 3 fusten worden aangesloten. Het fust wordt gevuld tot 1 cm onder de inlaataansluiting, om ruimte te laten voor de CO2 om binnen te komen. Daarna wordt het 3 keer gespoeld met CO2 om zoveel mogelijk lucht uit de lege ruimte te verwijderen.
Het is waar, niet meer (of minder) bottelen, maar toch moet er schoongemaakt en ontsmet worden. Reinigingssystemen voor fusten, zoals een pomp, zijn leuk, maar erg duur, dus doen we het met de hand. De fusten worden gedemonteerd en de kleinere elementen worden gedrenkt in een chlooroplossing. Het fust wordt vervolgens in elkaar gezet, voor ⅓ gevuld met een chlooroplossing en geschud. Vervolgens wordt het ondersteboven gekeerd en verschillende keren gespoeld met heet water. Uiteindelijk wordt het fust gevuld met CO2 om alle lucht te verwijderen. Het is noodzakelijk om de installatie en vooral de lijnen schoon te houden. We maken de lijnen minimaal één keer per week schoon als ze in gebruik zijn, we circuleren, door gebruik te maken van een leeg fust, een chlooroplossing en spoelen de lijn daarna goed door met water. Ook is het een goede gewoonte om de tapkraan en de aansluiting voor CO2 en bier schoon te maken en te ontsmetten. Zelf hebben we gezocht naar hoe dit het beste aan te pakken, welke materialen te kopen en tegen welke praktische zaken we zijn aangelopen. Dit willen we graag delen als tips voor de brouwer die ook graag zijn eigen ‘kegerator’ wil maken:
Leuk weetje: een video van onze koelkast is op Instagram gedeeld door een homebrewing-pagina en heeft 326.000 views. Bij verdere vragen: laat het ons weten. Marco Pipolo & Nicole Coenders – Kollergangers homebrewery |
|||||||||||||||||||||
| Terug naar overzicht | |||||||||||||||||||||
Klaren en Flocculatie |
tww september 2023 |
|
door: Jaap van der Veen en Chris Talbot Klaren (helder worden)Het helder worden van bier omvat veel factoren, van biochemisch tot mechanisch. Een helder bier is het resultaat van goede brouwtechnieken, kennis over de grondbeginselen van klaren, een goed filtersysteem, of een combinatie van alle drie. Tijdens het brouwproces kan men drie soorten troebelheid tegenkomen.
Een troebel bier wordt vaak toegeschreven aan gist die niet wil uitzakken, maar dat is maar een van de mogelijkheden. Gist blijft niet in suspensie zonder de juiste omstandigheden. Flocculatie (uitvlokking of samenklontering)Uitvlokking duidt op de mate waarin gist in staat is om samen te klonteren en grote ‘vlokken’ te vormen en dan uit (suspensie) te zakken. De definitie van uitvlokking luidt ‘omkeerbaar, aseksueel en calcium-afhankelijk proces waarbij cellen zich aan elkaar hechten tot vlokken’. Het is belangrijk om de basisprincipes van uitvlokking te begrijpen en hoe deze te beïnvloeden, omdat het uitvlokkings- en bezinkingsproces de eenvoudigste en goedkoopste manier is om helder bier te krijgen. Uitvlokking beïnvloedt eveneens het vergistingsproces en de smaak van het bier. Onder ideale omstandigheden blijft gist in suspensie en gaat het pas samenklonteren wanneer het gewenste eind SG is bereikt. Zoals de meeste brouwers weten, houdt gist zich niet altijd aan dit ideale scenario. De eigenschappen van de verschillende giststammen variëren van niet-uitvlokkend (1007 German Ale) tot zeer uitvlokkend (1968 London ESB). Niet-uitvlokkende gistGist die niet uitlokt heeft cellen die er glad uitzien onder een rasterelektronenmicroscoop en een negatieve oppervlaktespanning hebben. Wanneer deze gistcellen langzaam in suspensie zweven, stoten ze elkaar af (in tegenstelling tot gist die wel uitvlokt). Wanneer ze snel genoeg met elkaar botsen, zullen ze elkaar niet meer afstoten, maar ook zullen ze niet aan elkaar klonteren. Uitvlokkende gistGist die juist wel de neiging heeft om (al dan niet snel) uit te vlokken, heeft cellen die er onder de rasterelektronenmicroscoop uitzien alsof ze haartjes of stekels hebben. Ook deze cellen hebben trouwens een negatieve oppervlaktespanning die ervoor zorgt dat ze elkaar afstoten. Echter, wanneer ze onderling botsen, zal het afstoten eenvoudig teniet worden gedaan en klonteren ze samen. Lectin HypotheseDe Lectin hypothese is de actuele hypothese die beschrijft hoe gist uitvlokt/samenklontert. Deze hypothese beschrijft uitvlokking door middel van celwand-interacties, specifiek de binding tussen zymolectine en mannose-resten van mannan in de celwanden. Mannan bestaat uit lange vertakkingen van mannose-suikerketens die aanwezig zijn in de celwand. Mannan is aanwezig in de celwanden van alle gistcellen en zit vast aan lange peptideverbindingen die verankerd zijn in de celwand. Zymolectines zijn eiwitten welke door de gistcel worden geproduceerd en vervolgens worden uitgescheiden in de celwand. Zymolectines binden zich graag aan suikermoleculen en hebben calciumionen nodig om deze binding in stand te houden. Zymolectines binden eveneens aan mannose-resten van mannan in de celwand. Het kleven van zymolectine aan celwand-mannanen werkt eigenlijk net als klittenband. Wat de productie en activitatie van zymolectine veroorzaakt is nog niet bekend. Er wordt verondersteld dat zymolectine actief wordt na exponentiële groei, tijdens de stationaire fase. Waarschijnlijk veroorzaakt de uitputting van voedingsstoffen en de toename van vergistingsbijproducten (ethanol en veranderingen in pH) de productie en activatie van zymolectine. Er zijn twee fenotypes in giststammen te onderscheiden aan de hand van het type zymolectine dat ze produceren. Flo1 fenotypeIn het Flo1 fenotype binden zymolectines zich alleen aan resten van mannose en de zymolectines worden alleen geremd door mannose. In dit gisttype wordt flocculatie niet beïnvloedt door de groeifase van de gist. De meeste bovengisten vallen onder dit fenotype. NewFlo fenotypeIn het NewFlo fenotype binden zymolectines zich zowel aan mannose- als aan glucoseresten en worden geremd door mannose, glucose, maltose en sucrose. Flocculatie treedt laat in de exponentiële fase op en aan het begin van de stationaire fase. Dit fenotype bevat de meeste ondergisten en enkele bovengisten. Co-flocculatieCo-flocculatie kan optreden wanneer een flocculente en een niet-flocculente stam samen worden gebruikt. De combinatie van de twee uitvlokkingstypes kan ervoor zorgen dat beide stammen uitvlokken omdat de zymolectinen van de uitvlokkingsstam binden aan mannanen van de niet-flocculerende stam. Het is moeilijk te voorspellen of twee stammen co-flocculatie zullen vertonen, dus het is altijd belangrijk om kleinschalige fermentatieproeven uit te voeren voordat twee stammen samen worden gebruikt. Factoren die de samenklontering en aantrekking (flocculatie) van cellen bevorderenDe lectin hypothese beschrijft het mechanisme dat ervoor zorgt dat gistcellen samenklonteren, maar welke factoren bevorderen dit mechanisme?
Wat betekent dit alles voor de thuisbrouwer?Flocculatie en klaring zijn complexe kwesties en worden beïnvloed door vele factoren. Sommige van deze factoren liggen buiten de controle van de thuisbrouwer, terwijl andere wel te sturen zijn. Het manipuleren van factoren die flocculatie beïnvloeden, heeft een directe invloed op de smaak en het aroma van het eindproduct.
Gistbehandeling en flocculatie/klaringEnt-hoeveelheden:
Generatie:
ConclusieFlocculatie is een van de meest complexe en minst begrepen mechanismen van gist. Het is erg moeilijk om precies te bepalen waarom de flocculatie-eigenschappen van een giststam veranderen. Het goed bijhouden van eerdere resultaten in combinatie met goede en consistente brouwtechnieken zal het aantal onbekende factoren die van invloed zijn op gist minimaliseren. Bronhttps://wyeastlab.com/resource/home-enthusiast-clarification-flocculation/ |
|
| Terug naar overzicht | |
Dieper in het water gedoken (4) |
tww september 2023 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Door: Jan Wurpel
Door: Jan Wurpel
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Het lezen van een waterrapportHet oude gezegde “als je water goed smaakt, is het prima om ermee te brouwen” kan een gezegde zijn dat werkt voor een niet al te kritische thuisbrouwer, maar een professionele brouwer of een gepassioneerde amateur-brouwer kan de watersamenstelling niet negeren. Hoewel het waar is dat slecht smakend water slecht smakend bier zal opleveren, is het omgekeerde niet altijd waar. Waterchemie is ingewikkeld, maar we hebben voldoende informatie nodig om te begrijpen hoe geschikt brouwwater samengesteld dient te zijn. Het analyseren van de samenstelling van je beschikbare watervoorziening is een essentiële eerste stap. Zoals reeds in het tweede deel is aangegeven is water is een polair oplosmiddel, wat betekent dat elk watermolecuul polen heeft, of negatief en positief geladen uiteinden. De waterstofkant van het molecuul is positiever geladen dan de zuurstofkant, vanwege de elektronenverdeling. Door de polariteit van het molecuul kan het andere polaire moleculen aantrekken, zoals natriumchloride, calciumsulfaat en calciumcarbonaat. Polaire moleculen dissociëren (splitsen) vaak in positieve en negatieve ionen onder invloed van een polair oplosmiddel. In onderstaande tabel worden een aantal van deze ionen weergegeven.
Wat is een ion?Een ion is een atoom of een groep atomen met een netto positieve of negatieve lading als gevolg van het verlies of de winst van elektronen. Een ion kan positief of negatief geladen zijn door respectievelijk een tekort of een overschot van een of meer elektronen. Een ionische verbinding is een polair molecuul dat bestaat uit 2 of meer ionen die bij elkaar worden gehouden door ionische bindingen (d.w.z. elektrostatische aantrekking). De elektrische lading van een ion wordt aangegeven als een superscript na het chemische symbool voor het ion. In de natuur- en de sterrenkunde beschouwt men meestal geïsoleerde atomen of moleculen; in de scheikunde en de biologie bevinden de geladen atomen en moleculen zich doorgaans in een waterige oplossing (elektrolyt). In dat laatste geval spreekt men van een kation als het ion positief geladen is. Als het negatief geladen is spreekt men van een anion (uitgesproken als “an-ion"). Zo lost het mineraal natriumchloride, ook bekend als keukenzout, (NaCl) op in het kation Na+1 en het anion Cl-1. Het gehydrateerde mineraal calciumchloride (CaCl2•2H2O) valt uiteen in 1 Ca+2, 2 Cl-1 en 2 watermoleculen. Merk op dat de som van de positieve en negatieve ladingen voor alle ionisatieproducten van een enkele verbinding altijd nul is. Bijvoorbeeld, de +2 lading van het calcium en de twee -1 ladingen van de chloride-ionen zijn opgeteld tot nul. Dit is ook een goed punt om te stellen dat de som van de opgeloste kationen en anionen in een natuurlijke watervoorziening ook nul moet zijn. Parameters van een rapport over de waterkwaliteitVeel mineralen en verbindingen komen van nature voor in water en lossen op in de oplossing uit verschillende milieubronnen. Ook de mens levert hieraan een bijdrage die echter veelal ongewenst is. We spreken dan van verontreiniging. Verontreinigingen kunnen ook natuurlijk zijn: schimmels, bacteriën, nitraten, enz. zijn allemaal van nature voorkomende waterverontreinigingen. Het belangrijkste doel van waterbehandeling is het verwijderen van deze verontreinigingen en het doel van een rapport over de waterkwaliteit is om het publiek te informeren over de soorten en gehaltes van deze stoffen in de watervoorziening. We beginnen onze beoordeling van een waterrapport met het identificeren van de belangrijkste bestanddelen: de belangrijkste ionen, chemicaliën en verbindingen in typische drinkwatervoorzieningen. Rapporten over de waterkwaliteit richten zich op hoe het water voldoet aan de wetten voor veilig drinkwater voor verontreinigingen zoals pesticiden, micro-organismen en giftige metalen. Hoewel de primaire normen belangrijk zijn voor het waarborgen van de waterkwaliteit, zijn we als brouwers meestal meer geïnteresseerd in de secundaire of esthetische drinkwaternormen. Secundaire normen zijn richtlijnen voor parameters die van invloed zijn op smaak, pH en de gehaltes aan carbonaten. Deze laatste is bepalend voor de alkaliteit van het water. De bron van de openbare watervoorziening kan op bepaalde plaatsen per seizoen veranderen en dit kan een verschil maken in het karakter van leidingwater als brouwwater.
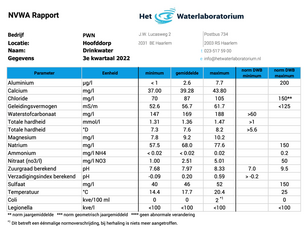
Van de parameters die van belang zijn voor brouwers, zijn de belangrijkste ionen die van invloed zijn op de prestaties van het brouwwater bij het maischen en fermenteren calcium (Ca+2), magnesium (Mg+2) en de totale alkaliteit als CaCO3, dat soms eenvoudig maar onvoldoende wordt vermeld als bicarbonaat (HCO3-1). Hun interactie in de maischketel, kookketel en fermentor beïnvloeden de pH en andere factoren tijdens het brouwproces. Natrium (Na+1), chloride (Cl-1) en sulfaat (SO4-2) kunnen de smaak van zowel water als bier beïnvloeden, maar hebben over het algemeen geen invloed op de pH of fermentatieprestaties zoals de eerste drie hierboven genoemde ionen. Concentraties ionen in water worden meestal weergegeven als delen per miljoen (ppm) of milligram per liter (mg/l), wat over het algemeen equivalent is in verdunde oplossingen zoals drinkwater, waarvan één liter ongeveer één kilogram weegt.
Niet-gereguleerde normen zijn industrierichtlijnen. DrinkwaterbedrijvenNederland telt tien drinkwaterbedrijven: Waterbedrijf Groningen (WBG), Waterleidingmaatschappij Drenthe (WMD), Waterleidingbedrijf Noord-Holland (PWN), Waternet, Dunea, Evides, Oasen, Vitens, Brabant Water en WML. Zij zorgen voor schoon en veilig water uit de kraan. Dat doen ze door grond- en/of oppervlaktewater te winnen, te zuiveren en via een leidingnet aan de klant te leveren. De drinkwaterbedrijven in Nederland produceren jaarlijks meer dan 1 miljard m3 drinkwater. RegelgevingDe Drinkwaterwet (Dww) en de onderliggende regelgeving reguleren onder meer de productie en de distributie van drinkwater door drinkwaterbedrijven. De wet bevat regels voor de kwaliteit, de leveringszekerheid en de bedrijfsvoering. In het Drinkwaterbesluit (Dwb) en de Drinkwaterregeling zijn respectievelijk de normen voor de kwaliteit van drinkwater voor menselijke consumptie en de vereisten voor monitoring en analyse opgenomen. Deze zijn gebaseerd op de Europese Drinkwaterrichtlijn. MeetprogrammaAlle drinkwaterbedrijven voeren een meetprogramma uit ter controle van de kwaliteit van het geleverde drinkwater. Het aantal metingen is gekoppeld aan de hoeveelheid drinkwater die ze dagelijks binnen een leveringsgebied produceren of distribueren. De drinkwaterbedrijven rapporteren de resultaten van het meetprogramma aan de ILT. Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) verzamelt en bewerkt de resultaten voor de ILT. Hiervoor gebruikt het RIVM het programma Registratieopgaven van drinkwaterbedrijven (REWAB). Eigen winningenOok eigenaren van collectieve watervoorzieningen (eigen winningen) moeten een meetprogramma uitvoeren. De ILT houdt toezicht op de kwaliteit van het drinkwater dat deze eigenaren produceren en leveren. Eigen winning is geen onderdeel van deze rapportage. Hieronder een voorbeeld van een waterrapport van ‘Het Waterlaboratorium’ van het water dat het PWN Waterleidingbedrijf Noord-Holland (PWN) levert aan het waternet Hoofddorp. Secundaire normen vanuit de regelgeving in de USASecundaire maximale verontreinigingsniveaus, Engelstalig: Secundary Maximum Contamination Level (SMCL). AluminiumSMCL = 0,2 ppm Chloride (ion)SMCL = 250 ppm KoperSMCL = 1 ppm IJzerSMCL = 0,3 ppm MangaanSMCL = 0,05 ppm SulfaatSMCL = 250 ppm ZinkSMCL = 5 ppm CalciumRichtlijn voor brouwwater = 50 – 150 ppm Calcium is in essentie smaakneutraal maar het kan de soms wat zure gewaarwording van magnesium reduceren. De aanbevolen concentratie aan calcium in het brouwwater is 50 – 150 ppm. Maar bier kan ook succesvol worden gebrouwen met meer of minder dan dit voorgestelde gebied. Oxalaat is aanwezig in gerstemout en reageert met calcium om biersteen te vormen. Calciumoxalaat kan op ieder punt in het brouwproces neerslaan, maar is in het bijzonder een probleem als het neerslaat in de fles of in het vat omdat de kristallen Calciumoxalaat werken als plaatsen waar gasvorming ontstaat en veroorzaakt overmatig schuimen en gushing. Het wordt aanbevolen om voldoende Calcium te hebben (d.w.z. 3 keer meer dan de oxalaat in de mout) om de neerslag eerder in het proces in gang te zetten, zoals in de maischketel of de kookketel in plaats van tijdens de fermentatie of in de verpakking. Calcium en magnesium concentratie worden vaak aangemerkt als zijnde tijdelijke en permanente hardheid. Tijdelijke hardheid kan worden weggenomen door te koken of met kalk verzachting, waar het zich combineert met bicarbonaat om dan neer te slaan als Calciumcarbonaat. CaCO3. Dit is de oorsprong van de eenheid. Als de alkaliteit als CaCO3 groter is dan de hardheid “als CaCO3” dan is alle hardheid tijdelijk. Als de hardheid “als CaCO3” groter is dan de alkaliteit als CaCO3 dan blijft een deel van de hardheid over na het koken en dat staat bekend als blijvende hardheid. Andere processen om calcium te verwijderen zijn ionen uitwisseling en omgekeerde osmose. MagnesiumRichtlijn voor brouwwater = 0 – 40 ppm FosfaatRichtlijn voor brouwwater = onbepaald (maar dient laag te zijn). Fosfaten vormen geen deel van de standaard richtlijnen voor bronwater, maar ze kunnen zowel een vervuiling voor het water zijn als een gebruikelijke toevoeging bij de waterbehandeling. Vervuiling komt meestal van de uitspoeling van agrarische oorsprong en industrieel afval en kan worden behandeld met aluminium- of ijzerzouten door het onoplosbaar te maken en het daarna uit te filteren. Fosfaatverbindingen overheersen in de mout en het wort. Hoge niveaus aan achterblijvende fosfaten zijn normaal in het afvalwater van de brouwerij en dit kan behandeld worden, op zowel aerobe als anaerobe wijze. Fosfaten kunnen ook verwijderd worden d.m.v. ionen uitwisseling, of omgekeerde osmose processen. KaliumRichtlijn voor brouwwater = < 10 ppm. Het vermogen om op te lossen van Kaliumzouten lijkt erg op die van Natrium, maar komt veel minder voor in natuurlijke watervoorzieningen. Hoge niveaus aan Kalium in bronwater kan veroorzaakt worden door overmatig slib, d.w.z. water met een hoge troebelheid. Kaliumionen kunnen naar zout smaken bij concentraties die hoger zijn dan 500 ppm. Wort en bier hebben relatief hoge natuurlijke concentraties aan Kalium (300 – 500 ppm), die door de mout wordt bijgedragen. Daarom is water dat verzacht is met Kalium potentieel net zo gevaarlijk als brouwen met water dat verzacht is met Natrium. Echter, het is te verkiezen boven natriumzouten als middel om het aantal kationen in het bier te verhogen indien de initiële hoeveelheden mout dit toestaan. Kalium kan worden verwijder d.m.v. omgekeerde osmose. NatriumRichtlijn voor brouwwater = 0 -50 ppm. Natrium kan in zeer hoge niveaus in drinkwater voorkomen, in het bijzonder als het water zachter is gemaakt met een op zout gebaseerde (Ionen uitwisseling) verzachter. In het algemeen is water dat zacht gemaakt is niet geschikt voor het brouwen, hoewel in zeldzame gevallen gecontroleerde verzachting zinvol is om ijzer en magnesium te verwijderen, ondanks een verhoging van Natrium. Voor niveaus aan Natrium van 70 - 150 ppm, maakt het de smaak van het bier ronder en accentueert het de zoetigheid van de mout, vooral in samenwerking met chloride-ionen. Natrium draagt bij aan een zoute smaak bij concentraties van 150 – 200 ppm en kan wrang en zuur gaan smaken als de concentratie de 250 ppm overstijgt. Brouwen met lagere concentraties zal over het algemeen een schonere smaak in het bier opleveren. De combinatie van een hoge concentratie aan Natrium en sulfaationen zal een zeer wrang, zuur/ bittere minerale smaak opleveren. Totaal Opgeloste stoffen [Total Disolved Solids] (TDS)SMCL = 500ppm. Richtlijn voor brouwwater = < 500 ppm. Het totaal aan opgeloste stoffen (Total Dissolved Solids) is wat overblijft als al het water verdampt. Sommige zijn zouten, sommige zijn organische stoffen en sommige zijn chemische residuen. Het totaal aan opgeloste stoffen is behulpzaam voor industriële doeleinden, maar is niet erg belangrijk voor de beschrijving van geschikt brouwwater. De indicator van het totaal aan opgeloste stoffen is een snelle indicator voor de mate van het gemineraliseerd zijn van de potentiële waterbron. Algemeen geldt dat water met een hoge TDS de neiging heeft om meer carbonaat af te zetten (aanslag te produceren) dan water met een lage TDS. Water met een hoge TDS heeft de neiging om meer corrosief te zijn dan water met een lage TDS, ofschoon de mate van corrosie sterk afhangt van de specifieke materialen die worden gebruikt. Het monitoren van TDS van een waterbron d.m.v. een (elektrische) geleidingstest is een goede manier om alert te kunnen zijn op plotselinge verandering in de waterbron. Het testen van het totaal aan vaste stoffen (TDS)Het totaal aan vaste stoffen van water wordt bepaald in het laboratorium. Een watermonster wordt gefilterd om alle zwevende materialen te verwijderen die de test zouden kunnen scheef trekken. Een afgemeten volume van het gefilterde water, verwarmd totdat alle vocht verdampt is en de eerder opgeloste stoffen achterblijven. De massa hiervan wordt gemeten en gedeeld door de hoeveelheid van het oorspronkelijke watermonster om het resultaat te kunnen bepalen, en wordt meestal uitgedrukt in milligrammen per liter (mg/L). In verdunde oplossingen voor drinkwater, is de mg/L doorgaans equivalent aan pats per million (ppm). TDS Kan ook worden geschat via de (elektrische) geleidingskarakteristieken van water. Een speciale meter wordt gebruikt om de geleiding van de oplossing te meten. Die geleidingswaarden kunnen worden gecorreleerd aan een schatting van de hoeveelheid TDS in de oplossing met de volgende vergelijking: TDS (pmm) = Geleiding (µS/cm) X F Waarbij F een conversiefactor is die gewoonlijk varieert tussen 0,54 en 0,96, met een meest voorkomende waarde van 0,67. De geleiding wordt gemeten in micro Siemens (µS) per cm of micro-mho’s per cm. (Mho is hierbij het omgekeerde van Ohm, wat gewoonlijk de weerstand betekent die een elektrische stroom ondervindt.) TDS meters die een directe uitlezing verschaffen zijn geleidingsmeters die de conversie vergelijking al in zich hebben TDS meters kunnen een waardevolle check op de waterkwaliteit opleveren op binnenkomend kraanwater of op de effectiviteit van waterbehandeling in de zin van water demineralisatie processen (RO, Nano filtratie, enz.). GeleidingsvermogenRichtlijn voor brouwwater = onbepaald. Specifieke geleiding of geleidingsvermogen is een maatstaf van het algemeen vermogen van een oplossing om een elektrische stroom te geleiden en hangt af van zowel het type als de hoeveelheid van de opgeloste substanties. Het werkt niet bepaald goed om verschillende waterbronnen met elkaar te vergelijken, maar het is zinvol voor het meten van variaties in één enkele waterbron, omdat het gecorreleerd kan worden aan TDS. Zuiver water is een isolator en geleid daarom geen stroom, maar wordt licht losgekoppeld bij een pH van 7 en heeft de neiging een geleiding te vertonen van 1 micro-Mho/cm. ( De grootheid Mho is het omgekeerde van een Ohm – de eenheid van elektrische weerstand. Totale alkaliteitRichtlijn voor brouwwater = < 100 ppm De alkaliteit is bediscussieerbaar de meest belangrijke parameter voor de brouwer, omdat het het grootste effect heeft op de prestatie tijdens het maischen.
Afhankelijk van de begin pH van het watermonster, kunnen zowel de carbonaat alkaliteit en de porties bicarbonaat van de alkaliteit deel zijn van de titratie en de som definieert de totale alkaliteit. Als de begin pH van het water hoger is dan 8,3, wordt de carbonaat alkaliteit gedefinieerd als de hoeveelheid zuur die benodigd is om de pH naar 8,3 te titreren. Dit wordt aangeduid als de P-alkaliteit en wordt doorgaans gemeten door gebruik te maken van een indicator op basis van oplossing met fenolftaleïne. Als de begin pH van het water lager is dan 8,3, is de bijdrage aan carbonaat niet veelzeggend en wordt het watermonster doorgaans getitreerd door gebruik te maken van een methyl oranje indicator welke een kleurgebied heeft van 3,2 tot 4,4 pH. Dit, door bicarbonaat gedomineerde deel van de titratie, wordt M-alkaliteit genoemd. De totale alkaliteit is de som van P-alkaliteit en M-alkaliteit. Het totale volume aan zuur dat nodig is om het eindpunt van de pH van 4,3 te bereiken wordt geconverteerd tot mEq/liter en vermenigvuldigd met het equivalent van 50 om de typische eenheid “totale alkaliteit, ppm als CaCO3" te verkrijgen. Maar, van de methyl oranje kleur verandering dat het 4,3 pH eindpunt bepaald wordt gezegd dat dit te fijn en moeilijk is om dit accuraat te observeren. De huidige ISO standaard specificeert het gebruik van de broomcresolgroen-methyl rood indicator oplossing, waarvan het eindpunt gedefinieerd is op 4,5 pH. Het besluit om welk pH eindpunt te verkiezen is aan het laboratorium, maar de ISO standaard is 4,5 pH. Het verschil in de beide methoden van het berekenen van het eindpunt verschilt niet veel, en bedraagt ongeveer 5%. De nauwkeurigheid is waarschijnlijk beter dan de resolutie van de meeste druppelaartesten die gebruikt worden bij aquaria en zwembaden, en is vergelijkbaar met de fout die potentieel geïntroduceerd wordt in het laboratorium bij het meten van de volumes van het monster en de reagentia. Het zoeken van contact met een laboratorium wordt aanbevolen als het eindpunt of indicator niet is gespecificeerd in het resultaat van de alkaliteit. Totale hardheidRichtlijn voor brouwwater = 150 – 500 ppm als CaCO3
Waarbij de vierkante haakjes [ ] de concentratie van de soorten ionen, in ppm, weergeeft Deze vergelijking converteert de individuele concentratie als de als CaCO3 equivalent. Andere bivalente ionen zoals ijzer, mangaan, chroom, zink, etc., leveren eveneens een bijdrage aan de hardheid, indien die in aanzienlijke hoeveelheden aanwezig zijn, en zullen worden daarbij worden opgeteld op een gelijke manier. Calcium en magnesium zijn de meest heersende stoffen in de hardheid van drinkwater. Wat is een MOLDe term “MOL” is afgeleid van “gram molecuul” en wordt gebruikt om een gelijke hoeveelheid chemische “dingen” te beschrijven door hun atomen of moleculen (of ionen of elektrische ladingen). Het is toepasbaar voor chemici voor het aanduiden van de hoeveelheden van “dingen” die betrokken zijn bij een chemische reactie. Daarom kunnen we zeggen dat 2 MOL waterstof reageren met 1 MOL zuurstof om 1 MOL water te vormen. Het interessante is dat de mol ontwikkeld werd met de komst van atomaire theorie en wetenschappers probeerden de atoommassa te kwantificeren. Er waren toen ten minste 3 kandidaten om tot standaard gekozen te worden, namelijk Waterstof, Zuurstof en Koolstof. Uiteindelijk werd het isotoop Koolstof 12 gekozen, en de MOL werd gedefinieerd als het aantal atomen in 12 gram koolstof. Daarvoor is het “getal van Avogadro” gedefinieerd als het aantal atomen in 1 MOL Koolstof 12, en dit aantal werd experimenteel bepaald op 6, 02214078 X 1023 +/- 1,8 X 1017. Een isotoop van een element heeft het zelfde aantal protonen in z’n kern als het moederelement, maar een verschillend aantal neutronen. Isotopen zijn gedefinieerd door het totaal aantal protonen en neutronen in de kern. Als voorbeeld hier de nomenclatuur Koolstof 12 wat betekend dat het atoom 6 neutronen bevat bovenop de 6 protonen, aangeduid bij z’n atoomnummer 6. Waterhardheid, Alkaliteit en Milli-equivalantenHardheid en alkaliteit van water worden vaak uitgedrukt “als CaCO3” omdat wanneer 100 mg calciumcarbonaat in 1 liter water wordt opgelost, gebruik makend van koolzuur (de weg imiterend zoals de natuur kalksteen oplost) zal de calciumhardheid en alkaliteit (zoals met de standaard methoden gemeten wordt) elk 100 ppm bedragen. De hardheid van water wordt in waterkwaliteitsrapporten veelal weergegeven als “Hardheid als CaCO3 of Totale Hardheid en is gedefinieerd als de som van de concentraties van calcium en magnesium ionen in Milli-equivalenten per liter (mEq/l), vermenigvuldigd met 50 (het equivalente gewicht van als CaCO3). De hardheid van water wordt vaak gemeten met een chelaat vormende test (chelaat = Molecuul dat op twee plaatsen met een metaal bindt, of verbinding van een organische stof (chelator) met metaalionen.) waarin een chemisch middel zoals EDTA wordt gebruikt om alle kationen te binden en te doen neerslaan vanuit een oplossing. Deze massa wordt gewogen, en dat gewicht per volume is de totale hardheid voor de oplossing. IJzer, Mangaan en andere metalen kunnen eveneens worden geteld in de chelaat vormende test, zodat het getal van de totale hardheid in het waterrapport vaak groter is dan de som van Calcium en Magnesium als CaCO3.
Als het ion een grotere lading bezit (bijv. 2), dan wordt 1 MOL van die stof gedefinieerd als (2) equivalenten. Daarom is een equivalent gewicht van een stof gelijk aan het MOL gewicht, gedeeld door het aantal equivalenten die het verschaft. Doorgaans is het aantal equivalenten van een stof gelijk aan diens lading van de valentie-electronen, zoals in het geval van Calcium, hoewel sommige stoffen laden met pH.
Equivalente gewichten zijn de sleutel voor het begrijpen hoe de concentratie aan Calciumionen in ppm zich verhoudt tot het getal van de “Totale Hardheid als CaCO3”. De omzettingsfactor is het equivalent van de stof. Het concept van equivalenten en equivalent gewicht wordt ingewikkelder met andere stoffen zoals koper en ijzer-elementen die een aantal verschillende oxidatietoestanden kennen (bijv. CU+1, CU+2, en Fe+2, Fe+3). Deze elementen elk hebben twee equivalente gewichten, afhankelijk van de andere stoffen in de reactie. Maar dat valt even buiten de beschouwing. Als een voorbeeld nemen we de berekening van de totale hardheid als CaCO3 van een watermonster van de concentratie kationen waarvan je de hoeveelheden ppm eerst moet converteren naar equivalenten. (Eigenlijk milli-equivalenten, aangezien een equivalent doorgaans gemeten wordt in MOL’s (d.w.z. grammen) per liter, en parts per miljoen zijn gram per liter. Dus, de eerste stap is om zowel de Ca als de Mg ion concentraties in ppm te delen door hun equivalente gewicht, wat hun concentraties in milli-equivalenten per liter oplevert. De conversiefactor tussen de Calcium hardheid en Calciumcarbonaat hardheid is de omgekeerde verhouding tot de equivalenten van hun gewicht, d.w.z. 50/20. Aangezien de totale hardheid als Calciumcarbonaat wordt gedefinieerd als zijnde de som van de Calcium hardheid en de Magnesium hardheid, worden de milli-equivalenten van Calcium en Magnesium bij elkaar opgeteld, en met 50 vermenigvuldigd (het equivalente gewicht van CaCO3 om de totale hardheid als milli-equivalenten per liter als CaCO3 te verkrijgen. Vergelijkbare conversiefactoren zijn samengevat in bovenstaande tabel. Om het samen te vatten, er kunnen honderden stoffen zijn in de watervoorziening, maar slechts een paar dozijn hebben een betekenis voor de brouwer. BronnenDe tekstdelen zijn voor een groot deel vertaald en bewerkt vanuit het boek ‘Water, a Comprehensive Guide for Brewers’ van John Palmer en Colin Kaminsky, met de volgende referenties aan geraadpleegde literatuur:
De kwaliteit van het drinkwater in Nederland in 2016. Inspectie Leefomgeving en Transport ILT/Water, Producten en Stoffen |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Terug naar overzicht | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Polderbok 2023 |
tww september 2023 |
 Door: Jacques Stricker
Door: Jacques Stricker
|
|
|
Clubblad september ’23
Bij de bestelling kan je aangeven waar je de polderbok wil afhalen: Bij bestellen verschijnt er een QR-code, druk deze af op papier of via je telefoon, want alleen bij het tonen van deze QR-code krijg je de bestelling mee. |
|
| Terug naar overzicht | |
Thiolen |
tww september 2023 |
 Door: Theo van Eijden
Door: Theo van Eijden
|
|
Gethioliseerde gist, illusie en de opkomst van designerbierThiolen zijn het coolste in het brouwen van hoppige bieren sinds de uitvinding van dryhoppen. Het is de nieuwste ontwikkeling op gistgebied en aan de andere kant van de grote plas gonst het van de geruchten. Dus waar komt al die opwinding vandaan bij onze mede-craftbrouwers? Wat Zijn Thiolen?Thiolen zijn zwavelhoudende verbindingen die vaak krachtige aroma's hebben. Waar brouwers enthousiast over zijn, zijn de tropische, wijnachtige en citrusachtige aroma's, terwijl andere thiolen intens onaangenaam zijn met geuren van knoflook of rotte eieren... Het thiol mercaptaan wordt aan aardgas toegevoegd om mensen te waarschuwen voor lekken. Het ‘schunky’ aroma van bier dat door licht is aangetast, is ook 3-methyl-2-butene-1-thiol. In tegenstelling tot veel andere bieraroma's die concentraties in ppm (delen per miljoen) of ppb (delen per miljard) vereisen, hebben veel thiolen een aromadrempel in het bereik van 5-70 ppt (delen per biljoen). Dit betekent dat er niet veel van nodig is om ze waar te nemen, maar het betekent ook dat er geen hoge concentraties nodig zijn om dominant te worden. Wat betreft positieve bier- en wijnaroma's, krijgen de thiolen die de meeste aandacht krijgen, de namen 4MMP, 3MH, 3MHA en 3S4MP. Deze hebben waarnemingen die variëren van passievrucht tot grapefruit tot rabarber. Dit zijn de intense aroma's die Nieuw-Zeelandse Sauvignon Blanc-wijnen hun kenmerkende geuren geven en die in lage hoeveelheden vrij voorkomen in veel Nieuw-Zeelandse hopsoorten. De meeste thiolen die in hop, mout en andere planten worden aangetroffen, zijn gebonden en dus niet actief aromatisch. Enzymen zijn nodig om ze vrij te maken. Er zijn wijngisten beschikbaar die hiertoe in staat zijn, maar het vergt meer werk om die genen in brouwersgist te krijgen. Waar komen thiolen vandaan?Gebonden thiolen komen zowel voor in mout als in hop, maar de niveaus variëren sterk. De binding die moet worden verbroken, komt in twee varianten voor: Cysteinylated (Cys) en Glutathionylated (Glu). Het overgrote deel (meer dan 90%) in zowel mout als hop is Glu. Het IRC7-gen in bepaalde wijngisten en Cosmic Punch gist van Omega (zie bron) kan alleen werken aan het minder voorkomende Cys. Hierdoor zijn mout-hoppen waarschijnlijk het meest gunstig voor Cosmic Punch, aangezien de enzymen in de beslagfase (vooral bij de temperatuur van de zuur-eiwitrust) kunnen helpen bij de omzetting van Glu naar Cys. Gelukkig hebben sommige minder dure hopvariëteiten de hoogste niveaus van gebonden thiolen, zoals Saaz, Cascade en Calypso. De intensere gist-varianten zoals Berkeley Yeast Tropics en Omega's Helio Gazer, Star Party en Lunar Crush kunnen eenvoudig worden toegevoegd aan een standaardrecept, met of zonder hop in het whirlpool-stadium. In plaats van meer kopieën van het IRC7-gen hebben ze een volledig ander gen dat Glu-thiolen direct kan vrijmaken. Het IRC7-gen in Cosmic Punch is afkomstig van gist, terwijl patB Omega in de meer krachtige varianten afkomstig is van een bacterie. Als voorbeeld kan je een keltelsauer vergist met een kleine dosis hexalon (geïsomereerd hopextract voor schuimvastheid) met London Tropics. Het resultaat wordt intens passievruchtig, zodanig dat het bijna als een fruitbier kan doorgaan. GM (genetisch gemodificeerde) giststammen zijn in Europa niet toegestaan in commerciële bieren. Ook zijn de genoemde gisten van Omega niet in Europa verkrijgbaar. Als gevolg hiervan zijn er laboratoria die werken met wilde isolaten die in staat zijn om thiolen vrij te maken voor co-vergistingen (bijvoorbeeld CHR Hansen – dat is voornamelijk bedoeld voor niet-alcoholische bieren) en stammen kweken met verhoogde capaciteiten om thiolen vrij te maken (bijvoorbeeld Escarpment). Omega werkte oorspronkelijk aan het kruisen van Engelse ale en een wijngiststam die in staat was om thiolen vrij te maken. Voor- en nadelen van gist die thiolen vrijmakenVoordelen
Nadelen
Meer is (niet altijd) beterIn eerste instantie lag de focus op het maximaliseren van de thiolconcentratie. Dit kon het gebruik van koudere vergistingstemperaturen, beslaghoppen en het modificeren van stammen met meer assertieve genen omvatten. Zoals bij de meeste aspecten van brouwen leidt het maximaliseren van één smaakverbinding meestal niet tot de beste algehele smaak of balans. Thiolen zijn doorgaans geen ‘primaire’ aroma's in bier, dus een bier met een overdreven hoge thiolconcentratie zonder andere aroma's om mee te spelen, kan kunstmatig smaken. Als algemene regel is om een meer ingetogen aanpak te gebruiken voor thiolen in lichtere/schonere/eenvoudigere bieren. Er is niet veel nodig om een unieke twist te geven aan een pils of Amerikaans tarwebier, terwijl een dubbel-drooggehopte DIPA of fruitbier mogelijk baat heeft bij een veel hogere hoeveelheid. Uiteindelijk gaat het om persoonlijke smaak en het doel dat je met een bier voor ogen hebt. Het toevoegen van thiolen maakt niet elk hoppig bier beter. Ze voegen een onderscheidende toon toe die de perceptie van passievruchtaroma's aanzienlijk kan verbeteren. Dat is een prachtige bijdrage wanneer je die smaken benadrukt, maar kan afleidend zijn of andere smaken verwarren. Bijvoorbeeld, het ‘mango-ijsje’ aroma van geweldige Simcoe hop. Echter, bij een van de intense giststammen zoals London Tropics of Helio Gazer in een volledig Simcoe-bier kan het meer generiek ‘tropisch’ worden in plaats van specifieke ‘mango’ smaak. Aan de andere kant helpt de thioltoon bij het dry hoppen met passievruchtige Galaxy of bij het brouwen met daadwerkelijke passievrucht om de bestaande aroma's te versterken. PhantasmHand in hand met gist die thiolen vrijmaakt, komt Phantasm. Het is in wezen de gedroogde en verpulverde restanten van de hoogst-thiol bevattende Nieuw-Zeelandse Sauvignon Blanc druiven. Hierdoor heeft het een hoge prijs van ongeveer USD35 per US pound. Het heeft voor gebruik in de vergisting geen geur. Toegevoegd tijdens het whirlpool-stadium voegt het een enorme hoeveelheid gebonden thiolen toe waar de gist mee kan werken. Tijdens de fermentatie ontstaat een duidelijke smaak en geur van ‘witte druif’ op die je niet krijgt bij andere gistfermentaties die alleen gebruik maken van graan en hop voor gebonden voorlopers. Veel hiervan slaat echter neer met de gist en de afgewerkte bieren zijn zelden zo onderscheidend. Echter de extra kosten van Phantasm zijn moeilijk te rechtvaardigen in een sterk drooggehopt bier waar de thiolen concurreren met andere sterke aroma's. Tenzij je die aroma's benadrukt met een hop zoals Nelson Sauvin. Phantasm past het beste bij daadwerkelijke witte wijn druiven, of in een eenvoudig basis bier waar het kan schitteren. LeerpuntenZijn thiolen een oplichterij? Nee, maar ze zijn ook geen innovatie die fundamenteel verandert wat nodig is om een heerlijk bier te maken. Overweeg een gist die thiolen vrijmaakt wanneer extra passievrucht-achtige aroma's je bier kunnen verbeteren. Maak je geen zorgen over het maximaliseren van de thiolen, tenzij ze concurreren met andere sterke aroma's. Zeer waarschijnlijk is dit slechts het begin is van nog meer exotische genetisch gemodificeerde giststammen. Bijvoorbeeld de gist van Berkeley’s de Sunburst Chico, die is aangepast om hoge niveaus van ananas-achtig ethylbutyraat vrij te maken. Als je een smaakverbinding kunt produceren zonder de kosten, milieueffecten en variabiliteit van het kweken ervan, zal de economische druk groot zijn om het toe te passen! Dat gezegd hebbende, heerlijke bieren maken draait niet om het maximaliseren van één of twee verbindingen, net zoals vanillesmaakstof goedkoop is, maar niet volledig de diepte en complexiteit van echte vanillebonen kan vervangen. Bronnen |
|
| Terug naar overzicht | |