Artikelen
6 artikelen uit het clubblad van Juni 2023
| Terug naar overzicht | |
Van het bestuur juni 2023 |
tww juni 2023 |
 Door: Peter Berger
Door: Peter Berger
|
|
Afgelopen ClubavondOp deze redelijk bezochte clubavond hebben we een mooie presentatie gezien van Bert Tas over het zelf thuis destilleren van alcohol. Hoewel het thuis destilleren in Nederland niet is toegestaan, wordt dit niet of nauwelijks gehandhaafd. We hebben veel informatie gekregen over de werkwijze en apparatuur die nodig is om thuis te kunnen stoken. Met veel voorbeelden en duidelijke uitleg was het een zeer informatieve avond. Na afloop van de presentatie waren we in de gelegenheid om wat whisky en likeuren te proeven. Deze waren zeer smaakvol en vooral de whisky was een aangename verrassing gezien het feit dat deze slechts 10 weken oud was. Voor degenen die niet aanwezig waren komt de presentatie binnenkort beschikbaar op de site van 't Wort Wat! Komende ClubavondIn juli is er geen clubavond en in augustus hebben we de jaarlijkse barbecue. De datum wordt wellicht nog aangepast in verband met een aantal andere activiteiten die samenkomen in het weekend van 26 augustus. Over de exacte datum en programma van de bbq zal nog informatie volgen. BrouwdagenOp de afgelopen clubavond hebben we een oproep gedaan voor het te brouwen bier op de komende brouwdagen. We wilden vooral iets maken wat je eigenlijk niet zo snel zou doen. Een beetje buiten je comfortzone dus. Kelvin van Geene kwam met het voorstel voor een Pastry Stout. Hier kun je een hoop ideeën in kwijt en het is zeker een bier dat we niet alledaags brouwen. Op de brouwdag in september gaan we dus een Pastry Stout brouwen. Het recept hiervoor gaan we nog uitwerken. Er zijn heel veel variaties van dit bier dus mocht je nog ideeën hierover hebben, stuur ze vooral naar bestuur@twortwat.nl. Voor de brouwdag in november willen we bij dezen opnieuw een oproep doen aan de leden om met ideeën te komen voor een mooi, uitdagend bier. Denk hierbij ook vooral aan iets wat je niet zo snel zou maken maar wat je wel graag een keer zou willen brouwen. Heb je suggesties, stuur deze dan naar bestuur@twortwat.nl. ExcursieEr is ook nieuws op het front van excursies, namelijk dat er weer eentje gepland wordt en wel op 13 oktober 2023. Er wordt druk gewerkt aan het programma maar het idee is om richting Belgie te gaan voor een of meer rondleidingen/proeverijen. In de komende maanden zal hier meer informatie over worden gepubliceerd. |
|
| Terug naar overzicht | |
Van de inkoopcommissie, juni 2023 |
tww juni 2023 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Door: Michael Woolthuis
Door: Michael Woolthuis
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Zoals ik vorige maand al schreef, zwart kan prima in de zomer. Hier dus een lekker stoutig recept voor een export Stout. Lekker eenvoudig wat hop betreft, dus je kan tijdens de kook alvast aan het bier want er is maar 1 hopgift dus je hoeft niet zo erg op te letten dat je niets vergeet. Zoals een echte stout is dit een heerlijk fris bier waar je lekker van kunt genieten op een warm terras. Je zou er eventueel nog wat aan toe kunnen voegen zoals een vleugje kers om alles nog wat zonniger te maken. Of juist de andere kant op door wat koffiebonen of cacaopoeder. Dan wordt alles wat meer koffietijdsmaak. Dan kan je er dus lekker vroeg op een warme dag mee beginnen. Groeten, Recept voor mei: StouterderReceptgegevens
Ingrediënten
Maischschema
Opmerking van de brouwer
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Terug naar overzicht | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Maandbier en ander geneuzel, 26 mei 2023 |
tww juni 2023 | ||||
 Door: John Gouwerok
Door: John Gouwerok
|
|||||
|
Het was een goede avond, wel een matige opkomst van ongeveer 35 leden. De reden was misschien dat het een keer niet over bier ging, maar over SPIRIT. Niet van de geest maar in de fles. Hoe je dat in de fles krijgt zal deze avond worden uitgelegd door een van onze leden. En er zijn twee maandbieren op tap, een van Guus v/d Veek, een klein kegfustje met Session IPA. Wel heel leuk maar ook snel leeg. Goed gewaardeerd en met opmerkingen als: ‘kruidig aroma’, ‘fris met een laag alcoholpercentage’ en ‘wat weinig afdronk’. 28 ingeleverde proefformulieren en het eindresultaat is 6.9 punten. Net iets meer dan de vorige keer dus een stijgende lijn. Dank. Hierdoor stimuleer je anderen ook om eens een maandbier in te zenden. De tweede inzending was ook een IPA maar dan een Mango IPA en wel van twee nieuwe leden: Nicole Coenders en Marco Pipolo die pas sinds 2019 brouwen. Zij zijn dus begonnen met experimenteren omdat ze op zoek waren naar iets nieuws om aan hun bier een natuurlijke, tropische boost te geven. Ze startten met verse Mango en na drie brouwsels de juiste balans gevonden!! en zoals je in het Latijn zegt (In medio stat virtus) voor de Mango. Het bier was in trek bij hun vrienden en ze wilden hun medeleden van 't Wort Wat! ook een keer laten proeven met het volgende resultaat: 33 proefformulieren en het eindresultaat is geworden 7.68 punten. NICOLE EN MARCO, DANK VOOR JULLIE INZET. Verder nog ben ik geweest in Melderslo bij het ONK en gezien dat 3 leden van 't Wort Wat! een eerste, tweede en derde plaats hebben gewonnen op een prima georganiseerd ONK festival. Veel te zien en te horen en goede bieren kunnen proeven van brouwerijen die ik niet kende. Ook het festivalbier en BBQ HOOFDDORP zat goed in elkaar. Daar was 't Wort Wat! eveneens ruim aanwezig, zowel als bezoekers en brouwers.
Dit was het weer, tot ziens, de volgend keer bij Klein Duimpje. |
|||||
| Terug naar overzicht | |||||
Dieper in het water gedoken (1) |
tww juni 2023 |
 Door: Jan Wurpel
Door: Jan Wurpel
|
|
InleidingAls ik wel eens aan amateur brouwers vraag wat voor ingrediënten ze gebruiken voor het vervaardigen van hun bier, weet men vaak wel specifiek de moutsoorten en hopsoorten te vertellen. En tegenwoordig weten ze ook de typen gisten, met hun karakteristieke eigenschappen, te benoemen. Als ik dan opmerk dat het grootste deel van het bier uit water bestaat wordt dat veelal beaamd vergezeld met een blik van “dat is toch evident”. Als ik opmerk dat bier doorgaans voor 90% tot wel 97% uit water bestaat en ze vervolgens vraag waar ze dat vandaan halen, wordt toch wel heel vaak geantwoord dat het uit de kraan komt. Ja, dat is voor veel amateurbrouwers waar. Die gebruiken enkel leidingwater voor hun brouwsels. Zelfs een bekende professionele brouwer uit Amsterdam brouwt met Amsterdams leidingwater. Hij vindt het heel deugdelijk water om mee te brouwen. Wellicht heeft hij gelijk, maar toch hoe zit het dan met de efficiëntie van het brouwproces? Hoe zit het dan met de smaak en geur, dus de beleving, van het bier. Is het mooi complex of tamelijk vlak (ééndimensionaal)? Voor het brouwen van een mooi en goed smakend bier is maisch/beslag nodig dat over een aantal eigenschappen dient te beschikken. Leidingwater van een waterleverancier is niet altijd even geschikt om er direct een goed bier mee te brouwen. Het oude gezegde “als je water goed smaakt, is het prima om ermee te brouwen” kan een gezegde zijn dat werkt voor een beginnende thuisbrouwer, maar een professionele brouwer of een gepassioneerde amateur-brouwer kan de samenstelling van het water waarmee gebrouwen wordt niet negeren. Hoewel het waar is dat slecht smakend water slecht smakend bier zal maken, is het omgekeerde niet altijd waar. Waterchemie is ingewikkeld! Het analyseren van de samenstelling van je watervoorziening is een essentiële eerste stap in het brouwproces. Die chemie is zeer bepalend voor de eigenschappen van water en bepalen of beïnvloeden een aantal karakteristieken zoals ‘de hardheid van water’, ‘de pH van water’ en ‘de alkaliteit van het water’. Ik merk dat deze laatste drie begrippen bij onze amateur-brouwers wel eens door elkaar gehaald worden en tot een verkeerd begrip kunnen leiden. Aan deze karakteristieken zal dan ook nog even aandacht worden besteed. Is de chemie van het bronwater belangrijk? Het antwoord is ja! Niet de chemie van het water op zich, maar de chemie van het uiteindelijke maisch/beslag is zeer bepalend. Om je een beter begrip te kunnen geven van wat water is en wat het doet in de bereiding van bier, nemen we je mee in een aantal hoofdstukken die de belangrijkste eigenschappen van water en de rol die het speelt bij de fasen van het brouwproces belichten. Het hoofdstuk over RestAlkaliteit (RA) is voor sommige personen wellicht wat moeilijk te volgen omdat er wel enige kennis van chemie voor nodig is om het te kunnen doorgronden. Aan de andere kant is water het meest essentiële onderdeel van een goede maisch, dat willen we jullie niet onthouden. Het is nagenoeg een complete vertaling van een deel van het boek ‘WATER’ geschreven door de onvolprezen auteurs John Palmer en Colin Kaminski. Eigenlijk een onmisbaar werk voor de gedreven, serieuze brouwer. De belangrijkste conclusies en wetenswaardigheden worden in dit hoofdstuk in kaders gepresenteerd. De hoofdstukken uit deze serie zijn de volgende:
Water, een fenomeen op aardeOngeveer 70 procent van het aardoppervlak is bedekt met water. Op aarde komt water in drie toestanden voor: als vloeistof (oceanen, zeeën, meren, rivieren en grondwater), als gas (waterdamp) en als vaste stof (ijs) Geschat wordt dat er op aarde zo'n, 1,386 miljard km3 water aanwezig is. Leonardo da Vinci omschreef water als ‘het bloed der aarde’. Hoe het water ooit op aarde terechtgekomen is laten we hier even achterwege. Water is essentieel in het bestaan van vele levensvormen en dus ook dat van ons. Gelukkig maar. Want zonder water waren wij, rondlopende waterzakken, er nooit geweest. 97,5% van het water is zout water dat zich vooral in oceanen bevindt. Slechts 2,5% van al het water bestaat uit zoet water dat gebruikt kan worden door planten, dieren en mensen. Echter, bijna 90% van dit zoete water is niet direct beschikbaar, omdat het nu nog opgesloten zit in ijskappen in Antarctica. Slechts 0.26% van al het water op aarde is beschikbaar voor mensen en andere organismen. Dit komt neer op ongeveer 93.000 kubieke kilometer. Slechts 0.014% van het water kan gebruikt worden als drinkwater, omdat het grootste gedeelte zit opgeslagen in wolken of in de grond. Nog even alles op een rijtje:
Water is essentieel voor het levenWater is de bron van alle leven en wordt beschouwd als een cruciaal onderdeel voor het ontstaan van leven. En zonder water was er waarschijnlijk nooit leven ontstaan op onze planeet. In het ruwe water zitten aminozuren die peptiden (mini-eiwitten) vormen, de bouwstenen van het leven. Scheikundigen van de gerenommeerde Purdue University hebben nu het mechanisme ontdekt waardoor deze peptidevormende reacties in water kunnen plaatsvinden. “Dit is in feite de chemie achter de oorsprong van het leven”. Ook het leven zelf is ontstaan in water. Nog steeds herbergen oceanen en meren de grootste diversiteit aan leven op aarde, dat loopt van virussen en bacteriën tot walvissen. Het menselijk lichaam bestaat voor ongeveer 55 à 60 procent uit water – bij mannen ligt het iets hoger dan bij vrouwen vanwege het verschil in vetgehalte. “Het grootste deel van dat water – bij een volwassen man toch al gauw zo'n 45 liter – zit in de cellen van ons lichaam: een cel is eigenlijk een zakje water met daarin verschillende structuren. Niet alle organen zijn overigens even waterrijk: de longen bestaan bijvoorbeeld voor 90 procent uit water; de huid voor 80 procent en de hersenen voor 70 procent. Botten en tanden bevatten toch ook nog respectievelijk 20 en 10 procent.” In ons lichaam is water ook een transportmiddel. Het verzorgt het transport van voedingsstoffen, vitaminen en mineralen, helpt bij de spijsvertering en voert afvalstoffen af. Verder controleert het de lichaamswarmte (door transpiratie) en werkt als smeermiddel voor de gewrichten en ogen. Wat is waterWater staat bekend als het ‘universele oplosmiddel’ bij uitstek, niet omdat alles erin oplost, maar wel omdat er veel meer stoffen in kunnen oplossen dan in enig ander oplosmiddel. Dit is een zeer belangrijke eigenschap voor alle levende wezens op onze aarde. Water is een bestanddeel van bijvoorbeeld speeksel in de mond maar ook van waterige oplossingen in de maag en de darmen. Water zorgt dat ons voedsel goed kan worden gemengd en verteerd. Water is ook een belangrijk bestanddeel van bloed. Daarnaast is water in ons bloed een ‘oplosmiddel’ voor hormonen en antilichamen. Die stoffen worden in het bloed getransporteerd van de plek waar ze worden gemaakt in het lichaam, naar de plek in het lichaam waar ze hun functie uitoefenen en daarmee is water ook een transportmedium. Water is namelijk overal om ons heen, op de aardbodem, in de lucht en het is in staat om essentiële stofjes (mineralen, zouten, voedingsstoffen) op te lossen en met zich mee te nemen. Verder is water het medium dat de mensheid in staat heeft gesteld er zich over te (laten) verplaatsen d.m.v. vaartuigen. Geraadpleegde bronnen
|
|
| Terug naar overzicht | |
ONK 2023 - Hertog Jan Grand Prestige kloonbier |
tww juni 2023 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Door: Patricia Talbot
Door: Patricia Talbot
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Na een toch al succesvol brouwjaar achter de rug, hebben Chris en ik deelgenomen aan het Open Nederlands Kampioenschap amateurbierbrouwen 2023. Wij hebben vier bieren ingestuurd, welke allemaal boven de 80 punten scoorden, waarbij onze Porter (7 jaar geleden geschreven voor de toenmalige Brand Porter wedstrijd) een mooie tweede plaats scoorde in de B-klasse. In de kloonbier klasse – Hertog Jan Grand Prestige, hebben wij met onze inzending de eerste plaats behaald.
RECEPT ‘Hertog Jan Grand Prestige’ kloonbier
Vergistbare ingrediënten
Hopgiften
Maischprofiel
Water
Watersamenstelling na toevoegingen:
Toevoegingen
GistWestmalle gist (WLP530 of Wyeast 3787) opgekweekt Vergistingsprofiel
Bottelsuiker
Veel brouwplezier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Terug naar overzicht | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dieper in het water gedoken (2) |
tww juni 2023 | |
 Door: Jan Wurpel
Door: Jan Wurpel
|
||
Chemische en fysieke eigenschappen van waterIntramoleculaire bindingen en structuurZuiver water bestaat uit enkel watermoleculen. Elk watermolecule is opgebouwd uit een zuurstofatoom gekoppeld aan twee atomen waterstof. Eenvoudig wordt dit weergegeven door de bruto formule H2O. Deze notitie kennen we waarschijnlijk allemaal wel. Maar hoe zijn deze atomen nu aan elkaar gekoppeld? Dit geschiedt door de koppeling, of binding, die de waterstofatomen aangaan met het zuurstofatoom. Een chemische verbinding kan ontstaan doordat de (valentie)elektronen van het ene atoom deel gaan nemen met de valentie-elektronen van een ander atoom. Kortweg: de twee of meerdere atomen gaan hun elektronen delen. Dit geschiedt totdat een verbinding ontstaat waarin de buitenste atoomschil van de verbinding 8 elektronen bezit (de edelgas configuratie, ook wel de octetregel genoemd). Een dergelijk type binding wordt een covalente binding genoemd. Een ander type binding is die waarbij een atoom een valentie-elektron geheel afstaat aan een ander atoom en er zo twee ionen naast elkaar ontstaan die elkaar vanwege hun verschil in elektrische lading aantrekken. Dit zijn de twee uiterste vormen van bindingstypen binnen een gevormd molecule. Een watermolecule is opgebouwd twee waterstofatomen en een zuurstofatoom die onderling een covalente binding aangaan. Dat wil zeggen dat de beide waterstofatomen hun enkele elektron delen met de 6 elektronen uit de buitenste schil van het zuurstofatoom. Nu is het zo dat de elektronen die (oorspronkelijk) bij het waterstofatoom behoren, als gevolg van het verschil in Elektron Negativiteit zich dichter bij het zuurstofatoom zullen bevinden. De elektronegatieve waarde (EN) is een maat voor de kracht waarmee een atoom extra elektronen naar zich toetrekt. Het zuurstofatoom bezit een grotere EN waarde dan de beide waterstofatomen. Daarom zullen de banen van de elektronen van beide waterstofatomen zich meer concentreren nabij het zuurstofatoom. Dat betekent dat de concentratie aan negatief geladen elektronen meer verschuift naar het zuurstofatoom. Rondom het zuurstofatoom is een grotere negatieve elektrische lading (wolk aan elektronen) aanwezig dan bij de uiteinden, waar de waterstofatomen zich bevinden. Dus, tussen de uiteinden van het watermolecule is de lading gemiddeld positief en rond het zuurstofatoom negatief. Zo ontstaat er een molecule met een dipoolmoment. Watermoleculen vormen zo zeer kleine dipolen. Zie het maar als een soort hele kleine magneetstaafjes. Dit geldt dan voor een enkel watermolecule. Eigenlijk ontstaat er zo een binding die tussen een zuivere covalente– en ionbinding in zit. Dit wordt dan ook wel een polair covalente binding genoemd. Bedenk wel dat dit bindingen zijn binnen één gevormd molecule. Dit zijn intramoleculaire bindingen. Intermoleculaire bindingen en structuurTussen de watermoleculen onderling zijn ook krachten werkzaam. Echter, die zijn vele malen kleiner dan de intramoleculaire bindingen. De krachten die watermoleculen onderling op elkaar uitoefenen worden 'intermoleculaire bindingskrachten' genoemd. Talrijke fysische eigenschappen van chemische verbindingen, zoals smeltpunt, kookpunt, oppervlaktespanning en oplosbaarheid, worden bepaald door deze intermoleculaire krachten. Zoals eerder aangegeven zijn enkele watermoleculen polaire moleculen. Als er meerdere watermoleculen aanwezig zijn, wat gewoonlijk het geval is als we over water spreken, vormen die een zekere rangschikking als gevolg van die intermoleculaire bindingskrachten. Er zijn drie typen krachten werkzaam: 1a. DipoolbindingDipool-dipoolinteracties zijn sterke intermoleculaire krachten (krachten tussen moleculen) die ontstaan uit de aantrekking tussen moleculen met een permanent dipoolmoment (zogenaamde polaire verbindingen). 1b. Dipool-dipoolbindingEen andere binding is de dipool-dipoolbinding, een binding tussen twee dipolen. Het δ+ deel van het ene dipool bindt aan het δ– deel van een andere dipool. Dipool-dipoolbindingen zijn vaak sterker dan vanderwaalsbindingen. 1c. Geinduceerde dipoolbindingGeïnduceerde dipool-dipoolinteracties zijn intermoleculaire krachten (krachten tussen moleculen) die ontstaan uit de aantrekking tussen een molecule met een permanent dipoolmoment (een zogenaamde polaire verbinding) en een polariseerbare molecule. 1d. LondonkrachtenOok wel dispersiekrachten genoemd, zijn intermoleculaire krachten (krachten tussen moleculen) die ontstaan uit de aantrekkende krachten tussen tijdelijke dipolen in anders apolaire moleculen. De londonkracht is de zwakste van de vier hier beschreven krachten. Deze vier krachten samen worden vanderwaalskrachten[1] genoemd. 2. WaterstofbrugDe sterkste intermoleculaire binding is de waterstofbrug, waterstofbinding, H-brug of H-binding (vier namen voor hetzelfde begrip). Voor de waterstofbrug is enerzijds een waterstofatoom nodig dat gebonden is aan een N-, een O- of een F-atoom. Anderzijds is er een ‘vrije kant’ nodig van een N-, O- of F-atoom. Deze vrije kant is δ– geladen, het H-atoom is δ+ en er zal een aantrekkingskracht zijn. Deze aantrekkingskracht is sterker dan bij een gewone dipool. Een watermolecule is niet nat. En een watermolecule is ook niet vloeibaar. 'Nat' en 'vloeibaar' zijn begrippen uit de macroscopische wereld en behoren tot de fysische eigenschappen van water. In de moleculaire wereld hebben deze begrippen geen betekenis. Water, zoals wij dat kennen en gebruiken, bestaat uit vele miljarden watermoleculen. De watermoleculen bewegen door elkaar heen. Wanneer de polaire watermoleculen dicht genoeg bij elkaar komen zullen ze zich binden aan elkaar. Het positieve deel van de waterstofatomen wordt aangetrokken door het negatieve deel van de zuurstofatomen. Deze binding wordt een waterstofbrug genoemd. Deze waterstofbruggen komen voor in vloeibaar water en zijn tevens verantwoordelijk voor de hexagonale kristalstructuur van ijs. Bij ijs zit elke watermolecule ruimtelijk vast in een kristalrooster en is verbonden met de vier dichtste buren. Als we ijs verwarmen, en het daarmee smelt, worden de krachten die de waterstofbruggen op de watermoleculen uitoefenen minder sterk en zal de structuur veranderen. De watermoleculen zijn nu niet meer strak in een ruimtelijk hexagonale kristalstructuur geordend en bewegen. IJs is nu vloeibaar geworden en wordt gewoonlijk water genoemd. Bij het verder verwarmen gaan de moleculen steeds verder van elkaar bewegen totdat een punt bereikt wordt dat de koppelingen van de watermoleculen, bewerkstelligd door waterstofbruggen, verbroken worden. De waterstofmoleculen bewegen nu geheel vrij door elkaar heen. Water is nu waterdamp geworden. Er zijn geen stabiele waterstofbindingen mogelijk. Waterdamp kan ook bij lagere temperaturen blijven bestaan! Waterdamp heeft een lage dichtheid en is gemakkelijk samendrukbaar. In het microscopisch model hebben de watermoleculen een gemiddelde afstand die veel groter is dan in de vaste stof. Deze moleculen bewegen daardoor vrij en willekeurig door de ruimte. Watermoleculen bewegen altijd totdat het absolute nulpunt qua temperatuur bereikt wordt (0° Kelvin = -273,15 °C). Beweging van moleculen zijn onlosmakelijk verbonden aan temperatuur van iets. Stoffen met waterstofbruggen mengen goed met elkaar en lossen daarom ook goed op in water. Dat is voor ons brouwers essentieel. Nu, als je water mengt met andere stoffen kennen we drie soorten resultaten die ontstaan:
Een stof is hydrofiel als het wordt aangetrokken door water en het goed oplost in water. Een hydrofiel deeltje is vaak gepolariseerd. De ladingen binnen het deeltje zijn niet gelijk verdeeld, daardoor kan het waterstofbruggen vormen. Stoffen die waterstofbruggen kunnen vormen zijn dan ook per definitie hydrofiel. Hydrofiel betekent letterlijk ‘waterlievend’. Het tegengestelde van hydrofiel is hydrofoob en betekent letterlijk ‘bang voor water’. Hydrofobe stoffen lossen niet of nauwelijks op in water. Hydrofobe stoffen worden soms ook wel lipofiele stoffen genoemd Voorbeelden van hydrofobe stoffen zijn vetten en oliën, deze zijn per definitie hydrofoob. De oorzaak dat hydrofobe stoffen niet met hydrofiele stoffen mengen, heeft te maken met de polariteit van een molecule. Hydrofobe stoffen zijn apolair, daardoor kunnen ze niet goed mengen met water, want dat is polair. Water is een goed en veel gebruikt oplosmiddel, maar zoals eerder aangegeven, lossen niet alle stoffen op in water. Water is een polaire stof. En alleen andere polaire stoffen kunnen in water opgelost worden. Polaire stoffen lossen op in polaire stoffen. Stoffen die niet polair zijn heten apolaire stoffen. Apolaire stoffen lossen op in apolaire stoffen. Maar… apolaire stoffen lossen niet op in polaire stoffen. Fysische eigenschappen van waterDe meest opvallende fysische eigenschap van water is het feit dat de densiteit (dichtheid) varieert met de temperatuur. Bij afkoeling neemt de dichtheid – net zoals bij alle andere stoffen trouwens – toe: d.w.z. het volume vermindert, het ‘krimpt’. De densiteit van water is het grootst op 4 °C. Beneden 4 °C neemt het volume opnieuw toe. Het water ‘zet uit’, wordt lichter en gaat over in ijs bij 0 °C. Dit specifieke gedrag heeft belangrijke gevolgen: in de winter vormt zich een drijvende ijslaag aan het wateroppervlak, die het onderliggende water, en het leven daarin, beschermt tegen de strenge vrieskou. Water heeft een uitzonderlijk oplossend vermogen. Daardoor is het een ideaal transportmiddel om voedingsstoffen naar alle delen van vele organismen te brengen en afvalstoffen weer af te voeren. Het zorgt eveneens voor afkoeling. Door te zweten verliezen we immers water, waardoor onze lichaamstemperatuur op peil wordt gehouden. Water warmt slechts langzaam op en zal die warmte ook maar traag afgeven. Anderzijds neemt het meer warmte op dan de meeste andere stoffen. Bij hoge temperaturen zullen zeeën en oceanen, maar ook de waterdamp in de atmosfeer, een groot deel van de zonnewarmte opslaan. Daardoor zal de watertemperatuur stijgen. De waterdamp die ontstaat, zorgt ervoor dat de zon niet genadeloos brandt bij heldere hemel. Wanneer het kouder wordt, zal het water de opgeslagen warmte afgeven. Op deze manier beschermt het water ons tegen extreme temperatuurverschillen. Het mooiste voorbeeld van dit effect – of beter gezegd de afwezigheid van dit effect – is de woestijn: daar is het overdag heet en 's nachts ijskoud. Bekijken we de viscositeit of mate van samenhang, dan merken we ook iets bijzonders. Ondanks de aanwezigheid van relatief sterke aantrekkingskrachten tussen de moleculen onderling, is water toch een beweeglijke vloeistof. Dit is het gevolg van de kleine afmeting van de watermolecule. Belangrijk is ook dat de viscositeit afneemt bij toenemende druk. Mocht water deze eigenschap niet bezitten, dan zou het slechts druppelsgewijs uit de kraan komen. Water is vloeibaar, maar toch worden kleine diertjes en voorwerpen gedragen door het water. Dit komt door de ‘oppervlaktespanning’, een soort buigzaam vliesje dat zich aan de oppervlakte vormt door de krachten waarmee de waterdeeltjes elkaar aantrekken. Gieten we heel voorzichtig water in een glas, dan zien we deze oppervlaktespanning aan het werk. Als het glas vol is, merken we dat het wateroppervlak een beetje bol staat. De huid van het water, de oppervlaktespanning, zorgt ervoor dat het glas niet overloopt. pH (potentia Hydrogenium)In veel literatuur over water en andere vloeistoffen zoals bier kom je vaak het begrip pH tegen. Maar wat is nu precies pH? De pH is een maat voor de zuurgraad (ook wel zuurtegraad) van een waterige oplossing. De exacte betekenis van de ‘p’ is niet bekend. Verklaringen lopen uiteen van potentia hydrogenii of pondus hydrogenii tot Potenz (Duits) of puissance (Frans) wat in alle talen ‘macht’ met betrekking tot machtsverheffen betekent, want de pH-schaal is immers logaritmisch. Het concept werd in 1090 voor het eerst geïntroduceerd door de Deense chemicus Søren P.L. Sørensen in het Carlsberg-laboratorium en in 1924 herzien naar het moderne gebruik. In water of in een waterige oplossing is een klein deel van de watermoleculen aanwezig in de vorm van ionen als gevolg van autoprotolyse. Autoprotolyse (ook wel aangeduid als auto-ionisatie of auto-dissociatie van water) of het waterevenwicht is een chemische reactie waarbij een waterstofion (H+) overgedragen wordt van de ene watermolecule naar de andere. Daarbij ontstaan twee ionen: het hydroxonium-ion (H3O+) en het hydroxide-ion (OH−). De reactie is een evenwichtsreactie die kan worden geschreven als: 2 H2O ↔ H3O+ + OH- Twee H2O-moleculen vormen dan een positief H3O+ ion en een negatief OH− ion.
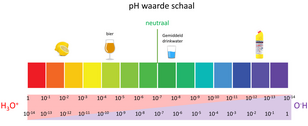
Het oplosbaarheidsproduct van de beide ionen in water is 10−14 mol/l (bij 22 °C), dat wil zeggen dat voor elke waterige oplossing geldt dat het product van de concentratie aan OH- en de concentratie van H3O+ altijd gelijk is aan 10−14 mol/l. Uitgaande van zuiver water is zoveel water in ionen opgesplitst dat zowel de concentratie H3O+ als de concentratie van OH− gelijk is aan: 1:10 000 000 = 10−7. Alle oplossingen met een pH van 7 worden neutrale oplossingen genoemd. Zo'n oplossing is niet zuur en ook niet basisch. De pH-schaal is niets anders dan een weegschaal met een logaritmische schaal die voor waterige oplossingen praktisch loopt van 0 tot 14. Een pH kleiner dan 7 betekent dat de oplossing zuur is, hoe lager hoe zuurder. Een pH groter dan 7 betekent dat de oplossing basisch is. Zo is zoutzuur erg zuur en zit nabij de 1 op de pH schaal. Citroen op ongeveer 2, bier tussen de 4 en 5. Zuiver water bezit een pH van 7 en het gemiddelde drinkwater in Nederland tussen de 7,2 en 8,5. Bleekwater is bijna het meest basisch met een pH van zo'n 12. Een Regeling van de minister van Volksgezondheid van 7 december 2017 stelt dat drinkwater een pH tussen 6,5 en 9,5 moet hebben. Voor de brouwer is de pH van de maisch uitermate belangrijk. De pH van de maisch in de ketel is een primaire factor voor het bepalen van de manier waarop de smaken van het uiteindelijke bier op het smaakpalet tot uitdrukking komen. Geraadpleegde bronnen
|
||
| Terug naar overzicht | ||